
(18分)锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是___________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
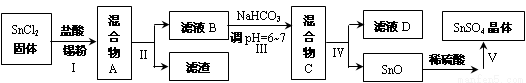
①步骤Ⅰ加入Sn粉的作用: ________________________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:____________________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是______________________________,证明已洗净。
⑤步骤Ⅴ操作依次为 _____________、____________、过滤、洗涤、低温干燥。
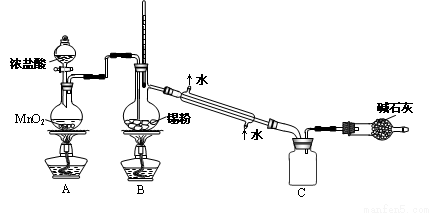
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
实验室欲用下图装置制备少量SnCl4 (夹持装置略),该装置存在明显缺陷,改进方法是__________。
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_____________________________________。
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl—、NO3— | 不能大量共存,Al3++3OH—=Al(OH)3↓ |
B | 由水电离出的c(H+) =1×10—13mol/L | K+、NH4+、Cl—、AlO2— | 能大量共存 |
C | pH=1的溶液 | Fe3+、NH4+、I—、SO42— | 不能大量共存, 2Fe3++2I—=2Fe2++I2 |
D | 通入少量SO2气体 | K+、Na+、ClO—、SO42— | 不能大量共存,2ClO—+ SO2+H2O=2HClO+ SO32— |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
紫苏醇的结构简式如右图所示。下列有关紫苏醇的说法正确的是
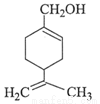
A.与乙醇互为同系物
B.一定条件下能与乙酸发生酯化反应
C.存在属于芳香族化合物的同分异构体
D.能与溴水、酸性高锰酸钾溶液发生加成反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe
D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:选择题
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法的是
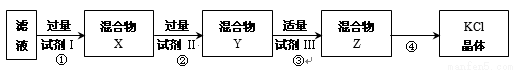
A.起始滤液常温下pH = 7 B.试剂Ⅰ为 Ba(NO3)2溶液
C.上图过程须经2次过滤 D.步骤③目的是除去 CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
(14分)如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
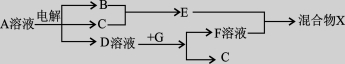
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列说法正确的是
A.小苏打可以用作胃溃疡患者的胃酸中和剂
B.二氧化硫可以用来漂白纸浆、毛、丝、草帽辫、银耳、米粉等
C.飞机播撒碘化银或干冰可实现人工降雨
D.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
下图是用于制取、收集并吸收多余气体的装置,下列方案正确的是
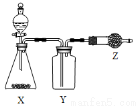
选项 | X | Y | Z |
A | 食盐、浓硫酸 | HCl | 碱石灰 |
B | CaO、浓氨水 | NH3 | 无水CaCl2 |
C | Cu、浓硝酸 | NO2 | 碱石灰 |
D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com