
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应的△H<0 | |
| B. | 若反应经过一段时间后,达到平衡时A的转化率为80% | |
| C. | 如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时 n(A)为0.11 mol | |
| D. | c(A)不随时间改变或单位时间里生成c和D的物质的量相等均可作为是否达到平衡的依据 |
分析 A、由此表格可知,温度越高,平衡常数越小,说明此反应为放热反应;
B、设平衡时A的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
C、依据v(A)=$\frac{c(A)}{△t}$计算即可;
D、依据此化学反应的特点可知,任何时刻均有生成C和D的物质的量相等.
解答 解:A、700℃时,平衡常数为1.7,1000℃时,平衡常数为0.6,故温度越高,平衡常数越小,说明此反应为放热反应,即△H<0,故A正确;
B、设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故$\frac{{x}^{2}}{(0.04-x)(0.16-x)}$=1,解得x=0.032所以平衡时A的转化率为$\frac{0.032}{0.04}$×100%=80%,故B正确;
C、反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.则6s时△n(A)=0.003mol•L-1•s-1×6s×5L=0.09 mol,故A剩余为:n(A)=0.2-0.09=0.11mol,故C正确;
D、由于C和D的化学计量数相等,故单位时间里生成c和D的物质的量相等不可作为是否达到平衡的依据,故D错误,故选D.
点评 本题考查化学反应速率、化学平衡常数的计算与运用等,难度较大,注意温度不变时,平衡常数不变,化学方程式相反时,平衡常数互为倒数.


科目:高中化学 来源: 题型:选择题
| A. | 闪电时,N2变为NO | B. | NO被空气中O2氧化为NO2 | ||
| C. | 工业上,N2和H2反应生成NH3 | D. | 豆科植物根瘤菌把N2变成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都是无色液体 | B. | 都是易挥发有刺激性气味的液体 | ||
| C. | 浓溶液在空气中都有白雾生成 | D. | 都是易溶于水的强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
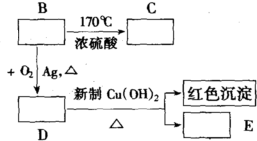
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验内容 | 实验目的 | |
| A | 测定同浓度的Na3PO4和Na2SO4水溶液的pH | 探究磷、硫两种元素非金属性的强弱 |
| B | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水溶加热 | 检验蔗糖是否已水解 |
| C | 将乙醇与浓硫酸共热产生气体直接通入酸性kMnO4溶液 | 检验乙烯的生成 |
| D | 向AgCl沉淀中滴加少量KI溶液,观察白色沉淀转化为黄色沉淀 | 验证Ksρ(AgCl)>Ksρ(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 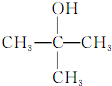 的名称为2-甲基-2-丙醇 的名称为2-甲基-2-丙醇 | |
| B. | 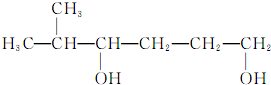 的名称为2-甲基-3,6-己二醇 的名称为2-甲基-3,6-己二醇 | |
| C. | 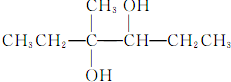 的名称为4-甲基-2,4己-二醇 的名称为4-甲基-2,4己-二醇 | |
| D. | 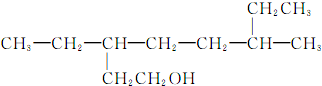 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H2O(g),平衡向正反应方向移动,体系压强减小 | |
| B. | 加入CO,混合气体的密度增大 | |
| C. | 降低温度,平衡向正反应方向移动 | |
| D. | 加入少量C,正反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com