
| A. | 滴入少量硫酸铜溶液 | B. | 加入适量2mol/L稀硫酸 | ||
| C. | 适当加热 | D. | 改用200mL lmol/L稀硫酸 |
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 |  |  |  | 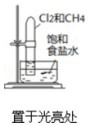 |
| 实验目的 | 验证铁钉发生了析氢腐蚀 | 验证Fe电极被保护 | 验证乙烯的产生 | 验证甲烷与氯气发生了化学反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③④ | C. | 只有①④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
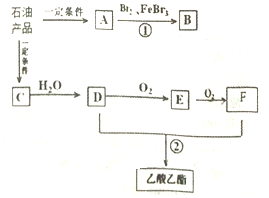 石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去).
石油是一种重要的资源,其常压蒸馏的产品在一定条件下能转化为芳香烃.A-F均为有机化合物,C的产量可以用来衡量一个国家的石油化工发展水平.它们的转化关系如图所示(部分产物和反应条件已略去). ,反应类型为取代反应;
,反应类型为取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.0 mL 18 mol•L-1 H2SO4溶液 | B. | 250.0 mL 2 mol•L-1 HCl溶液 | ||
| C. | 150.0 mL 2 mol•L-1 H2SO4溶液 | D. | 500.0 mL 3 mol•L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com