
【题目】在一个2L的密闭容器中投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
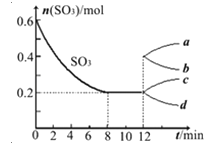
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
【答案】(1)0.4(2)0.0125mol/(Lmin)(3)B、C(4)C(5)逆;增大
【解析】
试题分析:(1) 2SO3(g)![]() 2SO2(g)+O2(g)
2SO2(g)+O2(g)
起始量(mol) 0.6 0 0
转化量(mol) 0.4 0.4 0.2
平衡量(mol) 0.2 0.4 0.2
平衡浓度(mol/L)0.1 0.2 0.1
根据该反应的平衡常数值为![]() =0.4。
=0.4。
(2)用O2表示0到8min内该反应的平均速率v=0.1mol/L÷8min=0.0125mol/(Lmin)。
(3)A、v(SO3)=2v(O2)中没有反应速率的方向,反应不一定达到平衡状态,A错误;B、正反应是体积增大的,则容器内压强保持不变,说明反应达到平衡状态,B正确;C、v(SO2)逆=2v(O2)正中正逆反应速率相等,说明反应达到平衡状态,C正确;D、容积和气体的质量均不变,因此密度是定值,则容器内密度保持不变不能说明反应达到平衡状态,D错误,答案选BC。
(4)在第12min时,容器压缩到1L,三氧化硫的浓度瞬间变为0.2mol/L,压强增大,平衡向逆反应方向进行,三氧化硫的浓度继续增大直至达到平衡状态,因此SO3的变化曲线为c曲线,答案选C。
(5)若保持容积不变在第12min时,加入SO3(g),则相当于增大压强,平衡向逆反应方向移动。SO3的体积分数增大。


科目:高中化学 来源: 题型:
【题目】某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
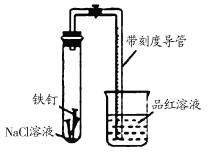
(1) 实验前用碱液清洗铁钉,再用0.100 mol/L的 H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_________ _____。
(2) 为尽量减小误差,下列操作的正确顺序是 ___(填序号)。
①装入铁钉
②插入注射器向铁钉表面滴入适量NaCl溶液并打开止水夹
③将导管口浸入品红溶液
④塞上单孔活塞
⑤检查装置气密性
(3)实验中试管内发生的总反应化学方程式为 ;
用该实验方案测量空气中O2的体积百分数时应测量的数据是:
①导管与试管内部空间总体积,② _。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充写出假设三:
假设一:电解质溶液的pH
假设二:NaCl溶液的浓度
假设三:________________
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度 | 0 cm | 1.3 cm | 8.5 cm | 8.4 cm | 8.5 cm | 8.5 cm |
形成稳定 液柱时间 | 3.0 min | 3.1 min | 5.1 min | 5.3 min | 15.6 min | min |
①当pH=2时,没有观察到稳定液柱形成的原因是_____________________。
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是________________。
③按上述实验装置,设计实验证明假设二。
第一步:配制不同浓度的NaCl溶液;
第二步:____________________,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6一 一区分开的试剂是 ( )
A. HCl溶液 B. 溴水 C. 酸性KMnO4溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g)![]() CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为 。
(2)关于上述反应在化学平衡状态时的描述正确的是 .
A.CO的含量保持不变 B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇(化学式为CH3OH),CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡常数表达式为:![]() ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。
(2)已知在400℃时,N2(g)+3H2(g)![]() 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A、缩小体积增大压强 B、升高温度 C、加催化剂 D、使氨气液化移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H在月球上储量丰富,4H主要来源于宇宙射线的初级粒子。下列关于3H和4H的说法正确的是
A. 两者互为同位素 B. 两者互为同素异形体
C. 两者为同一种核素 D. 两者具有相同的中子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com