
| A.①>④=②>③ | B.④>①>②>③ |
| C.④=②>①>③ | D.①>④>②③ |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:不详 题型:单选题
| A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

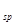 (Ni(OH)
(Ni(OH)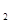 ): 5.0×10-16 ,K
): 5.0×10-16 ,K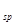 (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25 ℃时,CuS的溶解度大于ZnS的溶解度 |
| B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1 |
| C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成 |
| D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数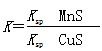 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP/250C | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaSO4的溶度积常数比BaCO3的小 |
| B.S没有毒性,C有毒性 |
| C.BaSO4的密度大 |
| D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL蒸馏水 | B.100mL 0.2mol·L-1 AgNO3 |
| C.100 mL 0.1mol·L-1AlCl3 | D.100mL 0.1 mol·L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com