

分析 (1)电解质溶液是通过自有移动离子来导电;
(2)溶液越稀,弱电解质的电离程度越大;
(3)若使c点溶液中c(Ac-)、pH值均增大,可以向溶液中加入碱或金属或某些盐.
解答 解:(1)电解质溶液是通过自有移动离子来导电,冰醋酸中只存在醋酸分子,无自由移动的离子,所以不导电,
故答案为:冰醋酸中只存在醋酸分子,无自由移动的离子;
(2)溶液越稀,弱电解质的电离程度越大,根据图象知,加入的水越多,溶液越稀,则醋酸的电离程度越大,故选c,电离平衡常数与温度有关,温度不变电离平衡常数不变,
故答案为:c;不变;
(3)若使c点溶液中c(Ac-)、pH值均增大,可以加入和氢离子反应的物质,
如①加较活泼金属,如Na/Mg/Zn等,生成氢气从而促进醋酸电离,
②加碱性氧化物或碱,如Na2O/NaOH等,氢离子和碱或碱性氧化物反应生成水,从而促进醋酸电离;
③加某些弱酸的正盐或酸式盐,如Na2CO3/NaHCO3等,氢离子和弱酸根离子反应从而促进醋酸电离,
故答案为:①加较活泼金属,如Na/Mg/Zn等,②加碱性氧化物或碱,如Na2O/NaOH等,③加某些弱酸的正盐或酸式盐,如Na2CO3/NaHCO3等.
点评 本题考查了弱电解质的电离,题目难度中等,本题注意分析图象,把握弱电解质的电离特征,注意氢离子浓度越大,其溶液的pH越小.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3molHNO3 | B. | 0.2molH3PO4 | ||
| C. | 3.01×1023个HNO3分子 | D. | 0.1molNH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
| 主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2O═O2-+2H+ | D. | Na2CO3═Na2++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.
,乙苯脱氢反应的平衡常数K如表所示;在体积为1 L的恒容密闭容器中充入0.2 mol乙苯蒸汽,在不同温度下进行乙苯脱氢反应.| T/K | 700 | 800 | 900 | 1 000 | 1 100 |
| K | 3.3×10-2 | 4.71×10-2 | 0.10 | 2.00 | 7.87 |
| A. | 乙苯脱氢反应是放热反应 | |
| B. | 800℃下达到平衡时,苯乙烯的体积分数为40% | |
| C. | 900℃下达到平衡时,乙苯的转化率为50% | |
| D. | 1 000℃下达到平衡时,H2的浓度为0.075 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
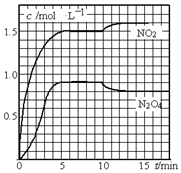 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com