
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 同温同压下,H2 (g) +Cl2(g) =2HCl (g)在光照和点燃条件下的△H不同
C. 保持其它条件不变,增加反应物的量或增大压强,反应速率就会随之改变
D. 使用催化剂会加快反应速率是因为催化剂降低了反应物的活化能
科目:高中化学 来源: 题型:
【题目】下列元素相关粒子的电子排布式中,前者一定是金属元素,后者一定是非金属元素的是( )
A. [Ne]3s1 [Ne]3s2 B. [Ar]4s1 [Ne]3s23p4
C. [Ne]3s2 [Ar]4s2 D. [He]2s22p4 [Ne]3s23p5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知An +,B(n+1) +,Cn -,D(n+1) -离子具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序为 ( )
A. A>B>C>D B. C>D>B>A
C. A>B>D>C D. D>C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图所示装置,收集一试管甲烷和氯气的混合气体,照后观察到量筒内形成一段水柱,认为有氯化氢生成。
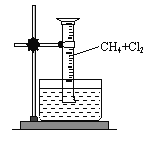
(1)该反应的反应类型为
(2)该反应的化学方程式为(只写第一步) ;
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)你认为该实验设计得出的结论是否正确的 ,
若不正确,理由是:
【实验三】
步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH = 1.00。
(5)判断该反应中有氯化氢生成的依据是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要氧化物,具有特殊的性质。下面是某化学学习小组对二氧化硫性质的验证实验。
(1)实验用品:分液漏斗、__________(玻璃仪器名称)、试管、具支试管、玻璃导管、乳胶管;亚硫酸钠晶体、硫酸(75%~90%)、NaOH稀溶液、NaOH浓溶液、酸性KMnO4溶液、Na2S稀溶液、酚酞试剂。
(2)实验装置

装置图中分液漏斗内的试剂是_________________________。
(3)实验步骤
①按照图示装置连接好实验仪器,检查装置气密性。检查方法是_____________________。
②在具支试管Ⅱ、Ⅲ、Ⅳ中分别加入2 mL NaOH稀溶液(溶液中滴有酚酞试剂)、2 mL酸性KMnO4溶液、2 mL Na2S稀溶液。其中Ⅱ中的实验现象是_____________________________;
Ⅲ中现象说明SO2具有__________性;Ⅳ中若持续通入SO2,写出发生反应的化学方程式:__________________________________。
(4)如果将具支试管Ⅲ内的酸性KMnO4溶液换为氯水,那么具支试管Ⅲ中发生反应的现象是_______________________,发生反应的离子方程式是_________________________。
(5)试管Ⅴ中加入的是NaOH浓溶液,其作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________。
(2)分子式为C9H20的某烃其一氯代物只有两种产物,写出符合要求的结构简式________________。
(3)分子式为C5H10的烯烃中不存在顺反异构的物质有_____种。
(4)已知烯烃、炔烃在臭氧作用下发生以下反应:

某烃化学式为C10H10,在臭氧作用下发生反应:C10H10![]() CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
②C10H10结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程,反应条件略。下列说法不正确的是

A. 途径l发生的反应是SO2+H2O2=H2SO4
B. 途径2增大O2的浓度可提高SO3的产率和SO2的转化率
C. ImolS完全反应生成SO3所放出的热量即为S的燃烧热
D. 若△H1<△H2+△H3,则2 H2O2 (aq)=2 H2O(aq)+ O2 (g)为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热电厂用碱式硫酸铝[Al2(SO4)3Al2O3]吸收烟气中低浓度的二氧化硫。具体过程如下:
(1)碱式硫酸铝溶液的制备
往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝(络合物,易溶于水),同时析出生石膏沉淀[CaSO4·2H2O],反应的化学方程式为____。
(2)SO2的吸收与解吸。吸收液中碱式硫酸铝活性组分Al2O3对SO2具有强大亲和力,化学反应为:Al2(SO4)3·Al2O3(aq)+3SO2(g)![]() Al2(SO4)3·Al2(SO3)3(aq) △H<0。工业流程如下图所示:
Al2(SO4)3·Al2(SO3)3(aq) △H<0。工业流程如下图所示:

① 高温烟气可使脱硫液温度升高,不利于SO2的吸收。生产中常控制脱硫液在恒温40~60oC,试分析原因_____。
② 研究发现,I中含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定不同参数的吸收液的pH变化,结果如下图所示:

据此判断初始阶段,SO2的结合方式是____。
比较x、y、z的大小顺序_____。
③ III中得到再生的碱式硫酸铝溶液,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降,请用化学方程式加以解释:____。
(3)解吸得到较纯的SO2,可用于原电池法生产硫酸。

① 电极b周围溶液pH_____(填“变大”、“变小”或“不变”)
② 电极a的电极反应式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com