
写出下列反应的离子方程式:
(1)CO2气体溶于足量NaOH溶液。
(2)NaHCO3溶液与盐酸反应。
(3)少量NaOH溶液滴入Ca(HCO3)2溶液中。
(4)足量NaOH溶液滴入Ca(HCO3)2溶液中。
(1)CO2+2OH-===CO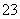 +H2O
+H2O
(2)HCO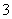 +H+===H2O+CO2↑
+H+===H2O+CO2↑
(3)Ca2++HCO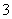 +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
(4)Ca2++2HCO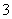 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO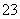 +2H2O
+2H2O
解析 (1)NaOH的电离方程式为NaOH===Na++OH-,CO2气体溶于足量NaOH溶液,反应实质为CO2与OH-的反应,所以离子方程式为CO2+2OH-===CO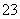 +H2O。
+H2O。
(2)NaHCO3在溶液中电离生成HCO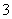 ,与盐酸反应实质为HCO
,与盐酸反应实质为HCO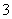 +H+===H2O+CO2↑。
+H+===H2O+CO2↑。
(3)Ca(HCO3)2和NaOH在水中存在形式分别是Ca2+、HCO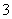 和Na+、OH-,发生反应的离子是HCO
和Na+、OH-,发生反应的离子是HCO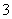 、OH-、Ca2+。当NaOH不足时,OH-全部反应,1 mol OH-需要1 mol HCO
、OH-、Ca2+。当NaOH不足时,OH-全部反应,1 mol OH-需要1 mol HCO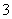 与之反应,生成的CO
与之反应,生成的CO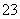 需要1 mol Ca2+与之反应,所以离子方程式为Ca2++HCO
需要1 mol Ca2+与之反应,所以离子方程式为Ca2++HCO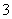 +OH-===CaCO3↓+H2O。
+OH-===CaCO3↓+H2O。
(4)当NaOH过量时,Ca2+和HCO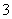 肯定全部反应,Ca(HCO3)2电离出的Ca2+和HCO
肯定全部反应,Ca(HCO3)2电离出的Ca2+和HCO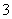 物质的量之比是1∶2,所以反应时也按1∶2反应,需要几个OH-就写几个,离子方程式为Ca2++2HCO
物质的量之比是1∶2,所以反应时也按1∶2反应,需要几个OH-就写几个,离子方程式为Ca2++2HCO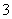 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO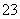 +2H2O。
+2H2O。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO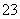
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO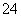
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH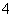
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br-,SO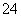 ,H2SO3,NH
,H2SO3,NH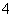 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO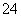 C.H2SO3 D.NH
C.H2SO3 D.NH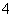
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序正确的是:( )
A.微粒半径:Na+>K+>Cl->S2- B.稳定性:HI> HBr>HCl>HF
C.酸性: HClO4>H2SO4>H3PO4>H2SiO4 D.熔点: Al > Mg > Na > K
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于吸热反应的是( )
①二氧化碳与赤热的炭反应生成一氧化碳 ②液态水汽化
③锌粒与稀H2SO4反应制取H2 ④Ba(OH)2·8H2O固体与NH4Cl固体反应
⑤生石灰跟水反应
A.①②④ B.①⑤ C.①③④⑤ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)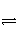
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语书写正确的是
A.乙烯的结构简式 CH2CH2 B.氯离子的结构示意图:
 C.H2O的电子式: D.碳酸钾的电离方程式 K2SO4 = K2++SO42-
C.H2O的电子式: D.碳酸钾的电离方程式 K2SO4 = K2++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com