
| A. | 密度比空气小 | |
| B. | 是无色无味的气体 | |
| C. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| D. | 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2 |
分析 A、二氧化硫的密度大于空气;
B、二氧化硫有刺激性气味;
C、二氧化硫与溴水发生氧化还原反应;
D、二氧化硫具有漂白性.
解答 解:A、二氧化硫的密度大于空气,而不是比空气小,故A错误;
B、二氧化硫有刺激性气味,而不是无味,故B错误;
C、二氧化硫与溴水发生氧化还原反应,所以SO2能使溴水褪色,说明SO2具有还原性,故C错误;
D、二氧化硫具有漂白性,所以紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2,故D正确;
故选D.
点评 本题考查二氧化硫的物理和化学性质,其中二氧化硫的漂白性,明确颜色的变化是解答本题的关键,并注意利用空气中常见的空气污染物的性质来解答即可,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
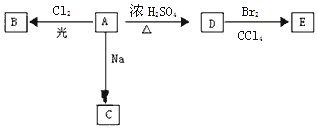
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中可以显酸性的物质是酸 | |
| B. | 电离时产生的阳离子中有H+的化合物是酸 | |
| C. | 电离时产生的阴离子全部是OH-的化合物是碱 | |
| D. | 盐只能电离出金属阳离子和酸根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | Pt4+提供孤对电子 | |
| C. | Cl-和NH3分子均与Pt4+配位 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
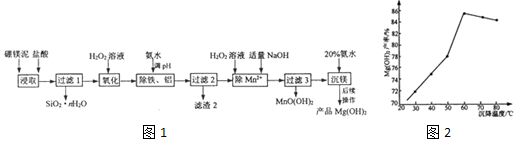
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精.下列有关该有机物的叙述正确的是( )
甲酸香叶脂(结构如图)为无色透明液体,具有新鲜蔷薇嫩叶的香味,可用于配制香精.下列有关该有机物的叙述正确的是( )| A. | 分子式为C11H18O2 | |
| B. | 含有羧基和碳碳双键两种官能团 | |
| C. | 能发生加成反应和水解反应 | |
| D. | 23gNa与过量的该物质反应生成标准状况下11.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 常温常压下,酸与碱反应生成1mol水时所放出的热量一定为57.3KJ | |
| D. | 放热反应的△H一定比吸热反应小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液:NH4+、Mg2+、SO42-、NO3- | |
| B. | 1.0mol/L的NaOH溶液:H+、Cu2+、I-、SO42- | |
| C. | c(H+)=0.001mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 能使含NH4+的溶液放出NH3的溶液:Na+、Mg2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com