
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是( )
A.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+) = c(OH-) + c(CH3COO-)
B.对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
C.常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
D.常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:Ka∶Kh=Kw
科目:高中化学 来源: 题型:
短周期元素X、Y、Z在周期表的位置如图所示,则下列说法正确的是( )
| X | ||
| Y | ||
| Z |
A.Z一定是活泼的金属
B.X的最高价氧化物的水化物是一种强酸
C.由Z的最高价氧化物形成的水化物是强酸
D.Y单质很难与H2化合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的叙述中正确的是( )
A.强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强
B.胆矾不能导电,所以它属于非电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同
D.强电解质都是离子化合物,弱电解质都是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol3·L-3。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液的pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中HF与CaCl2反应产生沉淀 D.该体系中没有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液
③ NaF溶液 ④ NaClO溶液。依据数据判断pH由大到小的顺序是 。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.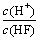 D.
D.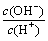
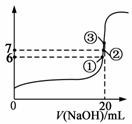 (3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
(3)25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
A.pH=3的HF溶液和pH=11的NaF溶液中,
由水电离出的c(H+)相等
B.在①点时pH=6,此时溶液中,
c(F-)-c(Na+) = 9.9×10-7mol/L
C.在②点时,溶液中的c(F-) = c(Na+)
D.在③点时V=20mL,此时溶液中c(F—) < c(Na+)=0.1mol/L
(4)在25℃时,Ksp[Cu(OH)2] =2.0×10-20。 某CuCl2溶液里C(Cu2+)= 0.02 mol·L-1,
如果要生成Cu(OH) 2沉淀,应调整溶液的pH使之大于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 在标准状况下,1mol水的体积是22.4L
B. 1mol H2所占的体积一定是22.4L
C. 1L 0.5mol/L的MgCl2溶液中,含有Cl- 的个数为0.5NA
D. 在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种非金属元素:①A比B容易与H2化合;②A原子能与B阴离子发生置换反应;③A的最高价氧化物水化物的酸性比B的最高价氧化物水化物的酸性强;④与某金属反应时,A原子得电子数目比B多;⑤A单质熔、沸点比B单质低。能说明A比B非金属性强的是( )
A.只有①② B.只有④
C.只有①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是( )
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40” ②碱式滴定管用蒸馏水洗后,未用待测液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液 ④滴定中不慎将锥形瓶内液体摇出瓶外 ⑤滴定达终点时,视线高于滴定管内液面凹面的最低点
A.①②④ B.②③④
C.②③⑤ D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com