
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是( )
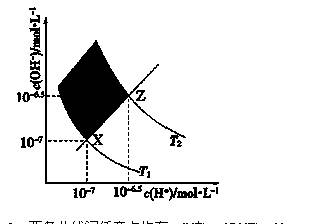
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
科目:高中化学 来源: 题型:
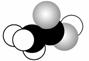
如右图所示是某有机分子的比例模型,黑色的是碳原子,白色的是氢原子、灰色的是氧原子。该物质不具有的性质是( )
A.与氢氧化钠反应 B.发生酯化反应
C.与稀硫酸反应 D.使紫色石蕊试液变红
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乙烯醇肉桂酸酯(A)可用于光刻工艺中做抗腐蚀涂层。下面是一种合成该有机物的路线:
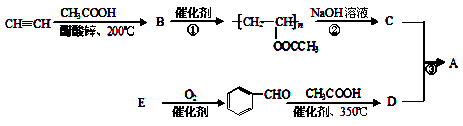
已知: 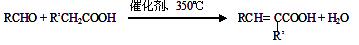
请回答:
(1)反应①是加聚反应,B的结构简式是 。B中的官能团的名称为
(2)反应②的反应方程式是 ;反应类型是 。
(3)E的分子式为C7H8O,E的名称是 ,其中符合下列条件的E的同分异构体的结构简式是 。
① 能与浓溴水反应产生白色沉淀 ②核磁共振氢谱有4种峰
(4)  能发生银镜反应,该反应的化学方程式是 。
能发生银镜反应,该反应的化学方程式是 。
(5)A的结构简式是 ,关于A的性质下列说法正确的是 (填字母)。
a.存在顺反异构
b.是通过加聚反应生成
c.能使KMnO4(H+)溶液和Br2(CCl4)溶液褪色
d.能发生取代反应、氧化反应、还原反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是电解CuCl2溶液的装置,其中a、b为石墨电极,则下列判断中,正确的是
A.a是阴极
B.电解过程中溶液的浓度不变
C.电解过程中b极质量减少
D.阳极与阴极上的产物的物质的量之比为11
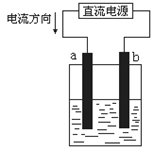
查看答案和解析>>
科目:高中化学 来源: 题型:
全球气候变暖已经成为全世界人类面临的重大问题。
(1)地球上的能主要于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ:H2O(l)=2H+(aq)+1/2O2(g)+2e- △H=+284kJ/mol
Ⅱ:CO2(g)+C5(s)+2H+(aq)=2C3+(s) △H=+396kJ/mol
Ⅲ:12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g)△H=-1200kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式
(2)工业上有一种方法有效地开发利用CO2,是用CO2生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1 L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)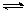 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如下图左所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min);
②氢气的转化率= ;
③求此温度下该反应的平衡常数K= ;
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1 c2的关系(填>、<、=)。
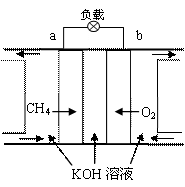
(3)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标。如上图右所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。将其插入KOH溶液,从而达到吸收CO2的目的。
① 通入氧气一极的电极反应式为 ;
② 随着电池不断放电,电解质溶液的pH
(填“增大”、“减小”或“不变”)。
③通常情况下,甲烷燃料电池的能量利用率
(填大于、小于或等于)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
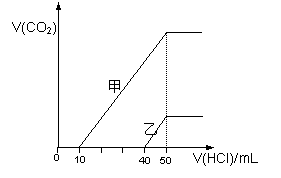
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子
方程式为: OH-+H+→H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为[CH3COO-]>[Na+]>[OH-]>[H+]
D.加入适量氨水,[CH3COO-]一定大于[Na+]、[NH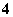 ]之和
]之和
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L溶液。
(1)该溶液中共含有______种不同的微粒(包括分子和离子)。
(2)在这些微粒中,________和________两种微粒的物质的量之和等于0.01 mol。
(3)________和________两种微粒的物质的量之和比H+的物质的量多0.008 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com