
 下列是部分金属元素的电离能
下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |


科目:高中化学 来源: 题型:
 (1)下列是部分金属元素的电离能
(1)下列是部分金属元素的电离能| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中富含氯元素。
(1)KCl广泛应用于医药和农业,KCl晶体中基态的氯离子电子排布式为
(2)下列是部分金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |
已知X Y Z 的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为
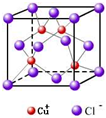
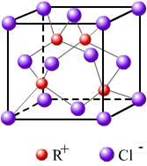
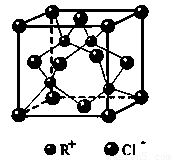
(3)RCl用作有机机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是 ,与同一个Cl-相连的 R+有 个。
(4) 卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3—CH2—Cl和碱溶液容易发生取代反应,而CH2=CH2—Cl 和碱溶液不起作用,请从结构上解释其差异
(5) HCl和 HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二下学期期末联考化学试卷(解析版) 题型:填空题
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
|
分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
|
C12H10ClN3O |
|
白色结晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为
________________(用元素符号表示)。
(2)氯吡苯脲熔点低,易溶于水的原因分别为 _ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
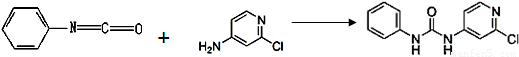
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键。
(4)含氮的化合物氨气水溶液逐滴加入硝酸银溶液中制备银氨溶液,写出银氨溶液的配制过程中沉淀溶解的离子方程式 。
Ⅱ.下列是部分金属元素的电离能
|
|
X |
Y |
Z |
|
第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为:
。
(6)RCl可用作有机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如下图所示。元素R基态原子的电子排布式 _ ,
与同一个Cl-相连的 R+有 个。
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:填空题

 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com