


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
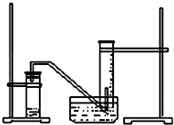 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?查看答案和解析>>
科目:高中化学 来源: 题型:
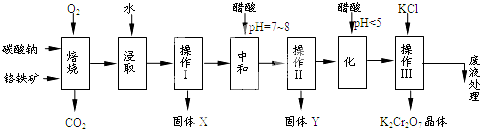
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0℃ | 40℃ | 80℃ | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B、NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C、NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D、NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
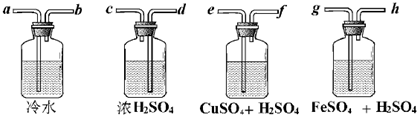
查看答案和解析>>
科目:高中化学 来源: 题型:
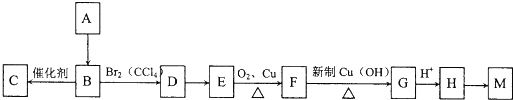
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AlCl3与纯HNO3反应 |
| B、用AlCl3溶液与Ba(NO3)2溶液反应 |
| C、用AlCl3溶液与NaOH反应,过滤得沉淀再加HNO3 |
| D、用AlCl3溶液与氨水反应,过滤得沉淀再加HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾是一种复盐,则NaAlO2也是一种复盐 |
| B、CaCO3的溶解度小于Ca(HCO3)2,则Na2CO3的溶解度小于NaHCO3 |
| C、在Ca(ClO)2溶液中分别通入CO2、SO2,前者生成CaCO3沉淀,则后者也生成CaSO3沉淀 |
| D、S、Cl两种元素为同周期元素,H2SO4为强酸,则HClO4也为强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com