

分析 (1)NO2与H2O反应中只有N元素的化合价变化;
(2)在加热和催化剂条件下,NH3与O2反应生成NO和水;
(3)a.氨液化后挥发带走能量,所以可用作制冷剂;
b.铵态氮肥溶解后铵根离子水解显酸性;
c.依据硝酸的性质和应用分析;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反,随反应进行硝酸变稀后生成一氧化氮;
(4)氨气在微生物的作用下与氧气反应生成HNO2,根据得失电子守恒配平方程式,然后判断;
(5)先写出氨气与氧气反应生成NO2(g)与H2O(g)的反应方程式,依据热化学方程式和盖斯定律含义计算得到所需热化学方程式的焓变,然后计算17g氨气与氧气反应放出的热量.
解答 解:(1)NO2与H2O反应中只有N元素的化合价变化,NO2既是氧化剂又是还原剂,故答案为:NO2;
(2)在加热和催化剂条件下,NH3与O2反应生成NO和水,其反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)a.液氨挥发过程中吸收能量,可用作制冷剂,故a正确;
b.铵态氮肥溶解后铵根离子水解显酸性,一般不能与碱性化肥共同使用,故b正确;
c.硝酸可用于制化肥、农药、炸药、染料、盐类等,故c正确;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应,随反应进行溶液浓度变稀后反应生成一氧化氮气体,生成NO2 小于1mol,故d错误;
故答案为:d;
(4)氨气在微生物的作用下与氧气反应生成HNO2,反应的方程式为2NH3+3O2$\frac{\underline{催化剂}}{△}$2HNO2+2H2O,反应中NH3为还原剂,O2为氧化剂,则氧化剂与还原剂的物质的量之比为
3:2;
故答案为:3:2;
(5)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-241.8kJ/mol,
②$\frac{1}{2}$N2(g)+O2(g)=2NO2(g)△H2=+33.9kJ/mol,
③$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H3=-46.0kJ/mol,
氨气与氧气反应生成NO2(g)与H2O(g)的反应方程式为4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)
由盖斯定律可知:①×6+②×2-③×4得 4NH3(g)+7O2(g)=4NO2(g)+6H2O(g)△H=-1199kJ/mol,
则17g氨气即1mol与氧气反应生成NO2(g)与H2O(g)的放出的热量为1199×$\frac{1}{4}$=299.75kJ,则NH3(g)+$\frac{7}{4}$O2(g)=NO2(g)+$\frac{3}{2}$H2O(g)△H=-299.75kJ/mol;
故答案为:-299.75.
点评 本题考查了氮及其化合物性质的分析应用,盖斯定律的应用和热化学方程式书写方法,是一道元素及化合物性质的综合题,难度中等,要求学生具备分析和解决问题的能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
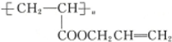 ,则醇A的结构简式为 ( )
,则醇A的结构简式为 ( )| A. | CH3CH2CH2OH | B. | CH2═CHCH2OH | C. | 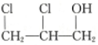 | D. | 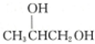 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
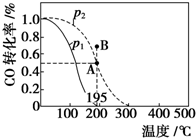 在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( )
在20L的密闭容器中按物质的量之比为1:2充入CO和H2,发生:CO(g)+2H2(g)?CH3OH(g)△H.测得CO的转化率随温度及不同压强下的变化如图所示,p2和195℃时n(H2)随时间的变化结果如表所示.下列说法正确的是( ) | t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | p1>p2,△H<0 | |
| B. | 在p2及195℃时,反应前3 min的平均速率v(CH3OH)=0.8 mol•L-1•min-1 | |
| C. | 在p2及195℃时,该反应的平衡常数为25 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.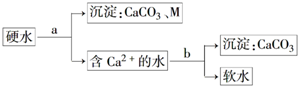
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol甲基(-CH3)中含有7NA个电子 | |
| B. | 1L 0.5mol•L-1的(NH4)2SO4溶液中含有NA个NH4+ | |
| C. | 在铜与硫的反应中,1mol铜失去的电子数为NA | |
| D. | 36g C5H12分子中含有8NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低反应所需的活化能 | |
| B. | 使反应体系的活化分子百分数增大 | |
| C. | 体系中活化分子总数不变 | |
| D. | 对于吸热反应、放热反应,反应速率同等程度加大 |
查看答案和解析>>
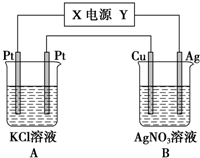
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com