
化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基且可以发生银镜反应;F分子中不含甲基:A与其它物质之间的转化如下图所示:
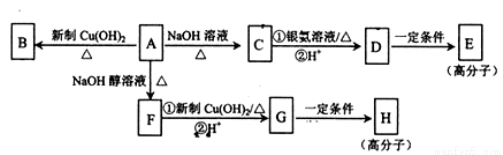
(1)A-F的反应类型是__________; G中含氧官能团的名称是_____________。
(2)A-C的反应方程式是___________。
(3)H的结构简式是______________,E的结构简式是__________。
(4)有的同学认为B中可能没有氯原子,你认为可能的原因是_____________。
(5)某烃的含氧衍生物X符合下 列条件的同分异构体中,核磁共振氢谱显示为2组峰的是________(写结构简式);只含有两个甲基的同分异构体有__________种。
列条件的同分异构体中,核磁共振氢谱显示为2组峰的是________(写结构简式);只含有两个甲基的同分异构体有__________种。
①相对分子质量比C少54;②氧原子数与C相同;③能发生水解反应。
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:实验题
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
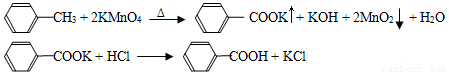
己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
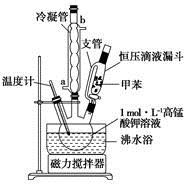
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
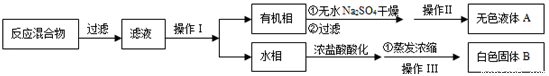
(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 |
|
② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
| 第一次 | 第二次 | 第三次 | 第四 |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:填空题
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是  。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为
。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为  (填写数值)。
(填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)=  mol
mol •L-1。
•L-1。
(4)FeCl3 在溶液中分三步水【解析】
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离 子方程式为:xFe3++yH2O
子方程式为:xFe3++yH2O Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
有Xn+、Ym+、Zn-三种离子,已知m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数,若按X→Y→Z的顺序,下列说法正确的是
A. 最高价氧化物对应的水化物的碱性依次减弱
B. 原子半径依次增大
C. 元素的第一电离能依次减小,电负性依次增大
D. 原子序数依次减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
已知C3N4晶体具有比金刚石还大的硬度,且 构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是
A.该晶体属于原子晶体,其熔、沸点很高
B.该晶体中每个碳原子上连有4个氮原子,每 个氮原子连接3个碳原子
个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子都满足最外层8电子结构
D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构
答
查看答案和解析>>
科目:高中化学 来源:2017届西藏林芝一中高三上月考四化学试卷(解析版) 题型:选择题
丹参素的结构简式为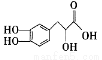 下列有关丹参素的说法错误的是( )
下列有关丹参素的说法错误的是( )
A.能燃烧且完全燃烧生成CO2和H2O B.能与NaHCO3、Na反应
C.可以发生酯化反应 D.不能发生加成反应
查看答案和解析>>
科目:高中化学 来源:2017届西藏拉萨中学高三上期末理综化学卷(解析版) 题型:选择题
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,QC为浓度商)
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,QC为浓度商)
A.QC不变,K变大,O2转化率增大
B.QC变小,K不变,O2转化率减小
C.QC不变,K变大,SO2转化率增大
D.QC增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三12月月考化学试卷(解析版) 题型:选择题
通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
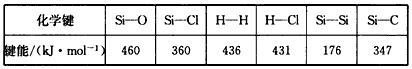
A.+412kJ/mol B.-412kJ/mol C.+236kJ/mol D.-236kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上月考二化学卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO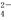 、Fe3+
、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO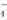 、Cl-
、Cl-
C.pH<7的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO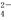 、Cl-、H+
、Cl-、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com