

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| D、除溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| E、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 |
| B、溶度积常数是不受任何条件影响的常数,简称溶度积 |
| C、可用离子积Qc判断沉淀溶解平衡进行的方向 |
| D、所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
已知:①将煤转化为水煤气的主要化学反应为C(s)+H2O(g)
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、488.3kJ?mol-1 |
| B、-244.15kJ?mol-1 |
| C、244.15kJ?mol-1 |
| D、-488.3kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把混合气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | HCl、CO2 | NaHCO3饱和溶液 | 澄清石灰水 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
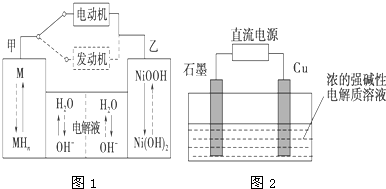 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 放电 |
| 充电 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③>①>④>② |
| B、③>①>②>④ |
| C、①>④>③>② |
| D、①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 mL 0.03 mol?L-1HCl溶液 |
| B、20 mL 0.02 mol?L-1KCl溶液 |
| C、30 mL 0.02 mol?L-1CaCl2溶液 |
| D、50 mL 0.05 mol?L-1AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com