
| A. | 硫酸钡 | B. | 石墨 | C. | 浓盐酸 | D. | HF |
科目:高中化学 来源: 题型:选择题
| A. | 在灼烧过程中使用的玻璃仪器有酒精灯、玻璃棒、坩埚 | |
| B. | 在上述氧化过程中发生反应的离子方程式为2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
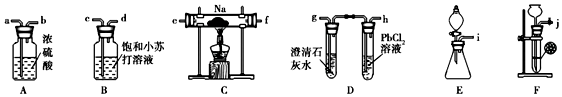
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 过滤操作时,漏斗颈下端不能紧靠烧杯内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.80 | 23.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com