
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.分析 Ⅰ.(1)分解反应是吸热反应且生成的氧化镁、氧化铝的熔点高;
(2)氧化镁是碱性氧化物,氧化铝是两性氧化物,依据二者性质不同除去;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于酸促进水解平衡正向进行;
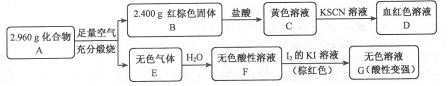
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=$\frac{2.400g}{160g/mol}$=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=$\frac{1.28g}{32g/mol}$=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,以此解答该题.
解答 解:Ⅰ.(1)2Mg5Al3(OH)19(H2O)4$\frac{\underline{\;\;△\;\;}}{\;}$27H2O↑+10MgO+3Al2O3 ,分解反应是吸热反应,降低温度,生成的氧化镁和氧化铝都是熔点很高的氧化物,附着表面会阻止燃烧,水蒸气稀释空气.
故答案为:反应吸热降低温度,固体氧化物隔绝空气,水蒸气稀释空气;
(2)氧化镁是碱性氧化物溶于酸,氧化铝是两性氧化物溶于酸、溶于碱,加入氢氧化钠溶解后过滤除去,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)氯化铵溶液中铵根离子水解溶液显酸性,氧化镁溶于水解生成的酸,反应的化学方程式为:NH4Cl+H2O?NH3•H2O+HCl,MgO+2 HCl=MgCl2+H2O或MgO+2NH4Cl+H2O=MgCl2+2NH3•H2O,
故答案为:NH4Cl+H2O?NH3•H2O+HCl,MgO+2 HCl=MgCl2+H2O或MgO+2NH4Cl+H2O=MgCl2+2NH3•H2O;
Ⅱ.C加入KSCN,D为血红色溶液,可知C为FeCl3,D为Fe(SCN)3等,可知B为Fe2O3,且n(Fe2O3)=$\frac{2.400g}{160g/mol}$=0.015mol,n(Fe)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,A燃烧生成的无色气体E溶液水得到酸性溶液,加入碘的KI溶液,得到无色溶液,说明碘可氧化E的水溶液,E应为SO2,F为H2SO3,G含有和H2SO4和HI,可知A含有Fe、S元素,且m(S)=2.96g-1.68g=1.28g,n(S)=$\frac{1.28g}{32g/mol}$=0.04mol,可知n(Fe):n(S)=3:4,应为Fe3S4,
(1)由以上分析可知,A组成元素为Fe、S,为Fe3S4,
故答案为:Fe、S;Fe3S4;
(2)铁离子具有强氧化性,可氧化铜,常用于制印刷电路板,
故答案为:制印刷电路板;
(3)化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518g•L-1),淡黄色不溶物为S,气体的相对分子质量为1.518×22.4L=34,为H2S气体,电子式为 ,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,
,反应的离子方程式为Fe3S4+6H+=3Fe2++S+3H2S↑,
故答案为: ;Fe3S4+6H+=3Fe2++S+3H2S↑;
;Fe3S4+6H+=3Fe2++S+3H2S↑;
(4)F→G反应的化学方程式为H2SO3+I2+H2O=H2SO4+2HI,溶液G中的主要微粒(不考虑H2O,H+,K+,I-) 为SO42-和H2SO3,可先检验SO42-,后检验有H2SO3,具体操作为:取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3.
故答案为:H2SO3+I2+H2O=H2SO4+2HI;取溶液G,加入过量BaCl2溶液,若产生白色沉淀,则有SO42-;过滤后取滤液,滴加H2O2溶液,若再产生白色沉淀,则有H2SO3.
点评 本题综合考查镁铝化合物性质,盐类水解的原理应用,无机物的推断,为高考常见题型,侧重于学生的分析、计算和实验能力的考查,注意把握物质的性质以及反应现象,结合质量守恒推断物质的组成,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com