
| A. | CH4和CO2属于分子晶体 | |
| B. | CO2和CH4分子中含有极性共价键,但都是非极性分子 | |
| C. | 因为碳氢键键能小于碳氧双键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |
分析 A.分子间通过分子间作用力形成的晶体属于分子晶体;
B.分子结构对称,正负电荷中心重叠的分子属于非极性分子;
C.熔沸点与分子间作用力有关;
D.根据中心原子的价层电子对数判断.
解答 解:A.分子间通过分子间作用力形成的晶体属于分子晶体,CH4和CO2属于分子晶体,故A正确;
B.CO2和CH4分子中含有极性共价键,分子结构对称,正负电荷中心重叠的分子属于非极性分子,故B正确;
C.熔沸点与分子间作用力有关,与共价键无关,分子间作用力越大,熔沸点越高,故C错误;
D.CH4的C原子的价层电子对数为4,属于sp3杂化,CO2分子中碳原子的价层电子对数为2,杂化类型sp,故D正确.
故选C.
点评 本题考查了分子晶体、分子极性的判断、熔沸点的比较、杂化类型的判断等,题目难度不大,侧重于基础知识的考查,注意把握杂化的判断方法.


科目:高中化学 来源: 题型:选择题
| A. | 砷元素的最高化合价为+3 | B. | 砷元素是第四周期第VA族的元素 | ||
| C. | 砷原子的M电子层有8个电子 | D. | 砷的氧化物的水溶液呈强碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
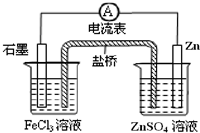 根据下列原电池示意图,回答下列问题:
根据下列原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ②④⑥ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D的最简式CH2;
;D的最简式CH2; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
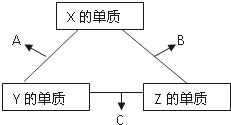 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
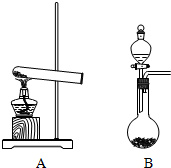 如图,实验室制取氨气有几种方法,
如图,实验室制取氨气有几种方法,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③⑥ | C. | ②④⑤⑥ | D. | 只有④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com