
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如右图所示。下列叙述正确的是
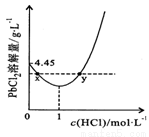
A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省高三上期初考试化学试卷(解析版) 题型:填空题
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24。(用元素符号或化学式表示)。
(1)Y、Z、W的第一电离能由小到大的顺序为 。
(2)J原子的核外电子排布式为 。
(3)Y2X2分子中Y原子轨道的杂化类型为 。
1mol Y2X2分子中含有σ键与π键的数目之比为 。
(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为 (任写一种)。
(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三小二调考化学试卷(解析版) 题型:选择题
下列各组中的两种物质相互反应时,无论哪种过量,都可用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②硫化氢气体与氯化铁溶液 ③硫酸铝溶液与氨水 ④碳酸氢钙溶液与澄清石灰水 ⑤碘化亚铁溶液与氯水
A.②③ B.①③④ C.②④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:填空题
磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)可逆反应PCl3(g)+Cl2(g) PCl5(g) 2E(g)
PCl5(g) 2E(g) F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:

①达到平衡I时,体系压强与反应开始时体系压强之比为 。
②平衡I到平衡II的条件①是 (填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示:
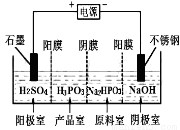
阴极的电极反应式为________________;产品室中反应的离子方程式为 。
(4)一定温度下,Ksp [Mg3(PO4)2] =6.0×10-29,Ksp [Ca3(PO4)2] =6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
查看答案和解析>>
科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:选择题
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
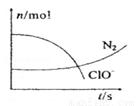
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源:2017届河北省等五校高三上学期第一次模拟化学试卷(解析版) 题型:选择题
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2。则与该有机物具有相同官能团的同分异构体的种类(不考虑立体异构)有
A.10种 B.11种 C.12种 D.13种
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期开学考试化学试卷(解析版) 题型:填空题
运用化学反应原理分析解答以下问题:
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
弱酸 | 电离平衡常数(25 ℃) |
HClO | K=2.98×10-8 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,降低温度,K值________(填“变大”“变小”或“不变”)。
②下列离子方程式和有关说法错误的是____________。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+H2O+CO2===2HClO+CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-===2HCO3-+SO32-
c.相同温度时,等物质的量浓度的三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为V(H2CO3)>V(H2SO3)>V(HClO)
d.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)<c(NaClO)<c(Na2SO3)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:___ 。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统会产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
Cr2O72- (橙色)+H2O。若改变条件使上述平衡向逆反应方向移动,则下列说法正确的是_______。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.达到新平衡后,溶液pH一定增大
d.再达平衡前逆反应速率一定大于正反应速率
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的Ksp=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
②CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
③CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为K1、K2、K3,则该温度下反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=________(用含K1、K2、K3的代数式表示)。向某固定体积的密闭容器中加入3 mol CO和3 mol H2,充分反应后恢复至原温度,测定容器的压强为反应前的1/2,则CO的转化率为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列溶液中c(NO3-)比100mL2 mol/L硝酸钡溶液中c(NO3-) 大的是( )
A .300mL 1mol/L的硝酸钠溶液
B .200mL 1.5mol/L的硝酸镁溶液
C .100mL 1.5mol/L的硝酸铝溶液
D .200mL 3mol/L的硝酸钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com