
| A. | 我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 | |
| B. | 光导纤维的主要成分是石英玻璃 | |
| C. | 新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) | |
| D. | 在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
分析 A.水泥的强度等级值越大,性能越好;
B.二氧化硅晶体可以用于制造光导纤维;
C.结构陶瓷和功能陶瓷具有优良的特性,属于新型陶瓷;
D.氧化亚铜为红色.
解答 解:A.水泥的强度等级值越大,性能越好,我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好,故A正确;
B.二氧化硅晶体可以用于制造光导纤维,则光导纤维的主要成分是二氧化硅晶体,即石英玻璃,故B正确;
C.结构陶瓷耐高温、耐氧化、耐腐蚀,功能陶瓷具有优良的特性,所以结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷)属于新型陶瓷,故C正确;
D.氧化亚铜为红色,在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈红色,故D错误.
故选D.
点评 本题考查了二氧化硅和硅酸盐材料,题目难度不大,题目涉及水泥、陶瓷、光导纤维、玻璃,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
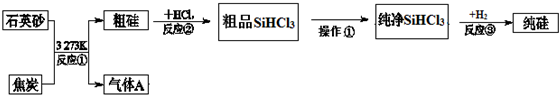
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
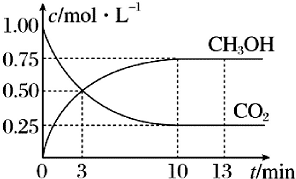 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )| A. | 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| B. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol•L-1•min-1 | |
| C. | 13min时,向容器中充入2mol氦气,该反应的化学反应速率增大 | |
| D. | 13min时,向容器中充入2mol CO2,该反应化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:2Na+2H+=2Na++H2↑ | |
| B. | 铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH═14+lg2x | B. | pH═14-lg2x | C. | pH═14+lgx | D. | pH═-lgx |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com