
【题目】下列物质中,既含极性键又含配位键的离子晶体是
A.Ba(OH)2B.H2SO4C.(NH4)2SO4D.CaF2
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液的微粒浓度关系正确的是
A. pH = 5的H2C2O4溶液中: c(H+) = c(HC2O4-) = 1×10-5mol·L-1
B. 氨水稀释10倍后,其c(OH-)大于原来的![]()
C. pH之和为14的 H2S与NaOH 溶液混合:c(Na+)+c(H+) = c(OH-)+c(HS-)
D. (NH4)2SO4溶液和NaOH溶液混合所得的中性溶液中:c(Na+)< c(NH3 H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板在科技领域具有不可替代的作用,它的制备方法为高分子化合物和铜箔压合,通过FeCl3溶液“腐蚀”而成。某实验小组在实验室用废弃的印刷电路板和“腐蚀液”提取铜的一种工艺流程如下:
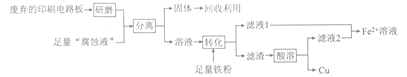
请回答下列问题:
(1) 检验“腐蚀液”中含有Fe2+的方法为_________________。
(2)“分离”所用的操作名称为____________,该操作所用的主要玻璃仪器有烧杯、_____________。
(3)用电解法在铁上镀铜时,阴极材料为_____________(填化学式),理论上电镀过程中电解质溶液的浓度_______________ (填“增大”“减小”或“不变”)。
(4) Fe2+溶液有很多重要用途。
①已知:常温下,Ksp[Fe(OH)2]=1.8×10-16。保存1.8mol·L-1的FeSO4溶液时,为确保溶液中不出现浑浊,应调节溶液的pH不超过_________________。
②Fe2+可使Ag+与Fe3+之间相互转化。一定温度下,0.1 mol·L-1的Fe(NO3)2溶液中,c(Fe3+)与c(Ag+)的关系如图所示:
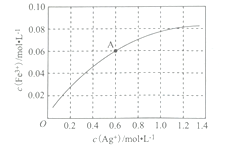
该温度下,A点溶液中转化反应的平衡常数为____________(溶液体积变化忽略不计);若将0.6mol·L-1 Fe(NO3)2溶液、0.15 mol·L-1 Fe(NO3)3溶液、0.06 mol L-1 AgNO3溶液等体积混合后,再加入1.08 g Ag,可观察到的现象为_________________________。
③Fe2+转化为Fe3+后,可用于制备高铁酸盐。向FeCl3溶液中加入NaOH、NaClO溶液制备Na2FeO4的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 液态HCl不导电,所以HCl是非电解质
B. NH3的水溶液能导电,所以NH3是电解质
C. 铜、石墨均能导电,所以它们都是电解质
D. 蔗糖在水溶液中和熔融时都不导电,所以是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①向某溶液中加入BaCl2溶液,生成白色沉淀,再加盐酸,沉淀不溶解,则原溶液中一定有SO42-
②向某溶液中加入CCl4,CCl4层显紫红色,证明该溶液中存在I-
A. 只有① B. 只有② C. ① ② D. 都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由NaCl、NaI、NH4Cl、Na2CO3、Na2SO3、Na2SO4中的一种或几种组成,准确称取4.7g该固体混合物进行如下实验(所加试剂均足量,气体体积己折算成标准状况):

根据实验结果,下列有关说法不正确的是
A. 原固体混合物中是否含有NaC1无法确定
B. 原固体混合物中必含有NH4Cl、Na2CO3、Na2SO3
C. 测定出“白色沉淀3”的质量可以确定混合物的组成
D. 若溶液1中只加BaCl2,则生成白色沉淀的质量必小于6.63g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是( )
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B. 酸性介质中KMnO4氧化H2O2:2MnO![]() +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C. 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D. 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com