
| 选项 | 操作 | 现象 | 结论 |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液 | 前者为黄色. 后者为红褐色 | 温度升高,Fe3+的水解 程度增大 |
| B | NaOH的乙醇溶液与溴乙烷共热,产生的气体通入 酸性高锰酸钾溶液中 | 溶液褪色 | 产生的气体为乙烯 |
| C | 铜铝合金加入一定量稀硝酸中,有金属剩余,再加稀硫酸 | 剩余金属质量减小 | 铝与稀硫酸反应使 剩余金属质量减小 |
| D | 盛有NO2的集气瓶中加入一定量水 | 气体变为无色 | NO2是酸性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水解为吸热反应,沸水中铁离子水解程度大;
B.消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化;
C.硝酸根离子在酸性条件下具有强氧化性;
D.二氧化氮和水反应生成硝酸和NO.
解答 解:A.水解为吸热反应,前者为黄色,后者为红褐色,可知沸水中铁离子水解程度大,则温度升高,Fe3+的水解程度增大,故A正确;
B.消去反应生成乙烯,但乙醇易挥发,乙烯、乙醇均能被高锰酸钾氧化,则溶液褪色,不能说明生成气体为乙烯,故B错误;
C.铜铝合金加入一定量稀硝酸中,生成硝酸盐,有金属剩余,再加稀硫酸,由于硝酸根离子在酸性条件下具有强氧化性,则金属进一步与硝酸根离子反应,故C错误;
D.二氧化氮和水反应生成硝酸和NO,而如为酸性氧化物,与水反应只生成酸,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及电离、水解、物质检验及有机物性质等,侧重物质的性质及化学反应原理、实验技能的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其反应速率 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| D. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
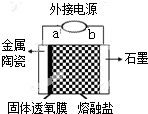 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,Ti4+在熔融盐中从左往右迁移 | |
| B. | 阳极电极反应式为2Cl--2e-=Cl2↑ | |
| C. | 已知每摩尔电子的电量为965 00 C,理论上生成48mg钛,则电解过程中通过电解池的电量为386 C | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
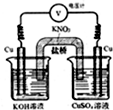 实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )
实验室利用如图所示装置.通过测电压求算Cu(OH)2的沉淀溶解平衡常数,工作一段时间后,两电极质量均增大.下列说法不正确的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的铜电极作正极 | ||
| C. | 总反应为Cu2+(aq)+2OH-(aq)?Cu(OH)2(s) | D. | 盐桥中的K+移向CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性: Fe3+>I2 |
| B. | 向盛有Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性: Cl>Si |
| C. | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液(每滴约0.02ml) | 先出现白色沉淀后又有红褐色沉淀产生 | 溶解度: Fe(OH)3>Mg(OH)2 |
| D. | 向H2S溶液中滴加CuSO4溶液 | 有黑色沉淀(成分为CuS)产生 | 酸性: H2S>H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
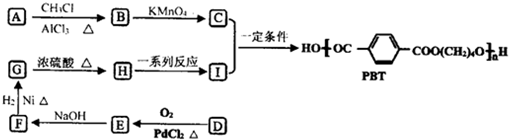

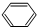 ,B的核磁共振氢谱有2个峰.
,B的核磁共振氢谱有2个峰.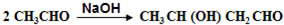 .
.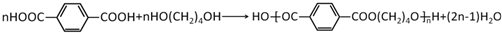 ,该反应类型为缩聚反应.
,该反应类型为缩聚反应.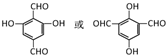 或
或 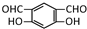 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温常压下,2.0g重水(D2O)中含NA个电子 | |
| C. | 1.0L0.1mo1•L-1的NaHCO3溶液中含HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com