
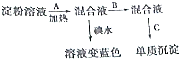
分析 淀粉在酸性条件下水解生成葡萄糖,加B试剂为碱中和催化剂酸性溶液呈碱性,然后加入C试剂银氨溶液,有单质银生成可检验产物葡萄糖;淀粉遇碘单质变蓝.
(1)淀粉水解的最终产物是葡萄糖;
(2)淀粉在稀酸作用下完全水解生成葡萄糖,与银氨溶液作用有单质银生成;
(3)银镜反应需在碱性条件下进行,淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液.
解答 解:(1)淀粉在酸性环境下水解的最终产物是葡萄糖,化学方程式为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6,
故答案为:(C6H10O5)n+n H2O$\stackrel{催化剂}{→}$n C6H12O6;
(2)葡萄糖与银氨溶液在水浴加热条件下发生氧化还原反应,C为银氨溶液,反应的方程式为CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH2OH(CHOH)4COONH4+H2O+2Ag↓+3NH3↑,单质沉淀是Ag,
故答案为:Ag;
(3)淀粉在酸性条件下水解生成葡萄糖,A为H2SO4作催化剂,银镜反应需在碱性条件下进行,淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性,然后加入银氨溶液,
故答案为:稀硫酸;催化剂;氢氧化钠;中和稀硫酸,使混合液呈碱性.
点评 本题考查了淀粉的水解、葡萄糖的检验,解答时需注意的是检验生成葡萄糖银氨溶液反应必须在碱性条件下进行,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑤ | C. | ②③⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com