
| A、Fe2(SO4)3 |
| B、稀HNO3 |
| C、AgNO3 |
| D、稀H2SO4 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CH3COOCH2CH2CH3 |
| B、HCOOC2H5 |
| C、CH3CH2COOC2H5 |
| D、CH3COOC(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向漂白粉中加入稀盐酸,有无色无味气体产生,则说明漂白粉已变质 |
| B、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C、溶液里加入盐酸,有能使澄清石灰水变浑浊的无色无味的气体生成,则说明溶液中一定含有HCO3- |
| D、溶液中加入稀硝酸后,再加少量AgNO3溶液,有白色沉淀生成,则溶液中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B、1.0mol/L NH4Cl溶液:c(NH4+)=c(Cl-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
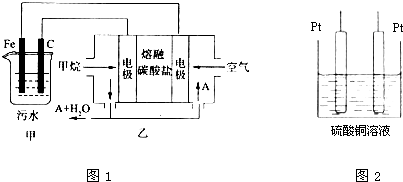
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向该溶液中加入KI溶液后,原有的5种离子的物质的量不变 |
| B、向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C、向该溶液中加入过量铁粉,只发生置换反应 |
| D、若溶液中c (Cl-)=0.6mol/L,则该溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| HNO2 | 4.6×10-4 | HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度平衡常数K减小 |
| B、若压缩体积,平衡向气体体积增大方向移动,混合气体的平均相对分子质量减小 |
| C、保持体积不变,通入稀有气体,压强增大,平衡向正反应方向移动 |
| D、T℃时,向2L密闭容器中加入 2molX、3molY、4molZ,反应将向左进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于5Q | B、5Q |
| C、5Q~10Q | D、10Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com