
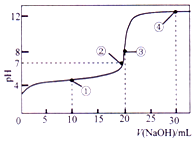
 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
分析 根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+);
点②pH=7,即c(H+)=c(OH-),c(Na+)=c(CH3COO-);
点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
点④加入30mL氢氧化钠溶液,此为溶质为CH3COONa、NaoH,且满足c(H3COONa)=2c(NaOH),结合电荷守恒和物料守恒判断.
解答 解:A.点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A正确;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),则c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;
C.点③说明两溶液恰好完全反应生成CH3COONa,根据质子守恒可得:c(H+)+c(CH3COOH)=c(OH-),故C错误;
D.④加入30mL氢氧化钠溶液,此为溶质为CH3COONa、NaoH,且满足c(H3COONa)=2c(NaOH),溶液中在电荷守恒:①c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒:②2c(Na+)=3c(CH3COO-)+3c(CH3COOH),根据①②可得:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH),故D正确;
故选AD.
点评 本题考查较酸碱混合的定性判断和计算、离子浓度大小比较,题目难度中等,综合考查学生的分析能力和化学基本理论的运用能力,为高考常见题型,难度中等,注意电荷守恒的运用.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:实验题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的氢气与氧气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低 | |
| C. | 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒的氧化性比硫弱 | B. | 可以存在至少三种以上的化合价 | ||
| C. | SeO3对应水化物的酸性比HBrO4弱 | D. | 硒化氢的分子式为SeH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com