

| A. | 煤和水煤气均是二次能源 | |
| B. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| C. | ①是将煤在空气中加强热使其分解的过程 | |
| D. | B为甲醇或乙酸时,原子利用率均达到100% |
分析 A.一级能源是指可以从自然界直接获取的能源,如:水能、风能、太阳能、地热能、核能、化石燃料;由一级能源经过加工转换以后得到的能源,称为二级能源,例如:电能、蒸汽、煤气、汽油、柴油、水煤气、干馏煤气等;
B.煤是由无机物和有机物组成的复杂的混合物;
C.煤在隔绝空气的情况下加热的过程称为煤的干馏;
D.水煤气为CO和H2,CO和H2在一定条件下按照不同的比例反应,可假定反应时的化学计量数之比为m:n,则只要各选项中的化学式能化为形式(CO)m(H2)n,都是正确的.
解答 解:A.煤是一次能源,故A错误;
B.煤是由无机物和有机物组成的复杂的混合物,通过干馏可得到苯、甲苯、二甲苯等有机物,故B错误;
C.①是煤的干馏,煤在隔绝空气的情况下加热的过程称为煤的干馏,故C错误;
D.甲醇(CH4O)可变为(CO)1(H2)2,乙酸(C2H4O2)可变为(CO)2(H2)2,故D正确.
故选D.
点评 本题考查煤和石油的综合利用,题目难度不大,注意绿色化学即反应物中的原子利用率达到100%,也就是说反应类型一般是化合反应,唯一的生成物即是产品.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
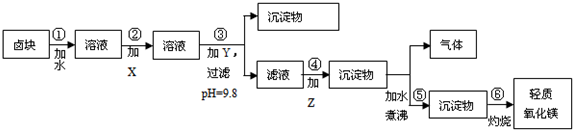
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| B. | 碘酒-混合物 胆矾-纯净物 臭氧-单质 | |
| C. | 葡萄糖-电解质 CO2-酸性氧化物 蛋白质溶液-胶体 | |
| D. | 氨水-电解质 硫酸钡-非电解质 酒精-有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:
某可逆反应的平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$,恒容时,温度升高H2浓度减小.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com