
分析 K2Cr2O7是橙红色的固体,有强氧化性.①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C,B为氯气,C为CrCl3 ;
②在C中加入KOH溶液,先生成灰蓝色沉淀D,应生成Cr(OH)3;
③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E,E为KCrO2;
④在E中加入H2O2加热则生成黄色溶液F,发生氧化还原反应生成K2CrO4;
⑤F用稀硫酸酸化,又变成原来的化合物A的溶液,即生成K2Cr2O7,
(1)分析氢氧化铬在溶液中存在平衡可知,氢氧化铬能溶于酸和碱符合两性氢氧化物的性质;
(2)浓盐酸处理产生黄绿色刺激性气味气体B为氯气和蓝紫色溶液C为氯化铬溶液,结合电荷守恒和一种守恒配平书写离子方程式;
(3)在C中加入KOH溶液,先生成灰蓝色沉淀D为Cr(OH)3 ,溶解度是一定温度下100g水中达到饱和溶解溶质的质量,计算溶质物质的量,得到平衡浓度计算溶度积常数;
(4)加入过量的KOH溶液则沉淀消失,变成绿色溶液E为CrO2-,结合原子守恒配平书写离子方程式;
(5)在E中加入H2O2加热则生成黄色溶液F为CrO2-被过氧化氢氧化为CrO42-,依据离子方程式电子守恒定量关系计算;
(6)①将试样溶于盐酸中生成SnCl2和氢气;
②SnCl2溶液中加入过量的FeCl3溶液发生氧化还原反应生成氯化亚铁和SnCl4;
③重铬酸钾A是强氧化剂应存在酸式滴定管中;根据n=cV计算反应中消耗的K2Cr2O7的物质的量;根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:(1)分析氢氧化铬在溶液中存在平衡可知,
Cr3++3OH-?Cr(OH)3?H2O+HCrO2?H2O+H++CrO2-
蓝紫色 灰蓝色 绿色
氢氧化铬能溶于酸和碱符合两性氢氧化物的性质,属于两性氧化物;
故答案为:两性;
(2)浓盐酸处理产生黄绿色刺激性气味气体B为氯气和蓝紫色溶液C为氯化铬溶液,结合电荷守恒和一种守恒配平书写离子方程式为:Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O;
故答案为:Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O;
(3)在C中加入KOH溶液,先生成灰蓝色沉淀D为Cr(OH)3 ,溶解度是一定温度下100g水中达到饱和溶解溶质的质量,溶解度为2.06×10-7g,计算溶质物质的量=$\frac{2.06×1{0}^{-7}g}{103g/mol}$=2×10-9mol,溶液密度近似为水,1000g水即1L溶液,得到平衡浓度c(Cr3+)=2×10-8mol/L,c(OH-)=6×10-8mol/L,计算溶度积常数Ksp=c(Cr3+)×c3(OH-)=2×10-8mol/L×(6×10-8mol/L)3=4.32×10-30;
故答案为:4.32×10-30;
(4)加入过量的KOH溶液则沉淀消失,变成绿色溶液E为CrO2-,结合原子守恒配平书写离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O;
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(5)在E中加入H2O2加热则生成黄色溶液F,为CrO2-被过氧化氢氧化为CrO42-,反应的离子方程式为:
2CrO2-+3H2O2 +2OH-=2CrO42-+4H2O
3 2
5mol n
参加反应的H2O2是5mol,则生成的黄色离子的物质的量为$\frac{10}{3}$mol;
故答案为:CrO42-;$\frac{10}{3}$;
(6)①将试样溶于盐酸中生成SnCl2和氢气,反应的化学方程式为:Sn+2HCl=SnCl2+H2↑;
故答案为:Sn+2HCl=SnCl2+H2↑;
②SnCl2溶液中加入过量的FeCl3溶液发生氧化还原反应生成氯化亚铁和SnCl4,反应的化学方程式为:SnCl2+2FeCl3=SnCl4+2FeCl2 ;
故答案为:SnCl2+2FeCl3=SnCl4+2FeCl2;
③重铬酸钾A是强氧化剂应存在酸式滴定管中;现有金属锡样品wg,经上述各步反应后,用A溶液滴定,共用去cmol•L-1的A溶液vmL(锡的相对原子质量用M表示).反应的离子方程式为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O,SnCl2+2FeCl3=SnCl4+2FeCl2 ,Sn+2HCl=SnCl2+H2↑;根据n=cV计算反应中消耗的K2Cr2O7的物质的量根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量;n(Cr2O72-)=cmol•L-1×v×10-3L=cv×10-3mol;
根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
3 1
n cv×10-3mol
n=3cv×10-3mol
样品中锡的质量分数=$\frac{3cv×1{0}^{-3}mol×Mg/mol}{wg}$×100%=$\frac{0.3cvM}{w}%$
故答案为:酸式;$\frac{0.3cvM}{w}%$.
点评 本题考查无机物的推断以及物质含量的测定,为高频考点,侧重于学生的分析、实验和计算能力的考查,题目涉及物质组成的实验探究过程分析判断,离子方程式书写和定量关系的计算应用,主要是滴定实验的计算应用,注意把握实验原理以及相关物质的性质,难度中等.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸(  )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用 和HCHO 为原料合成 和HCHO 为原料合成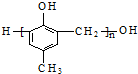 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl-)大量减少 | |
| B. | ①的滤液中不含有Ag+ | |
| C. | ②的现象说明该温度下Ag2S比Ag2SO4更难溶 | |
| D. | ③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| B. | 盐析可提纯蛋白质并保持其生理活性 | |
| C. | 油脂可以在酸性条件下水解生成高级脂肪酸和甘油 | |
| D. | 氨基酸和蛋白质均为天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com