
| A. | ① | B. | ② | C. | ③ | D. | ④ |
分析 ①发生反应:3NO2+H2O=2HNO3+NO,3体积二氧化氮反应生成1体积NO,溶液体积为2体积;②发生反应:4NO2+O2+2H2O=4HNO3,4体积二氧化氮反应消耗1体积氧气,剩余3体积氧气,溶液体积等于5体积;③中HCl溶解,溶液体积等于HCl的体积;④中氨气溶解,溶液体积等于氨气的体积,结合c=$\frac{n}{V}$计算判断.
解答 解:①发生反应:3NO2+H2O=2HNO3+NO,3体积二氧化氮反应生成1体积NO,溶液体积为2体积,则所得硝酸的浓度为$\frac{\frac{3VL}{22.4L/mol}×\frac{2}{3}}{2VL}$=$\frac{1}{22.4}$mol/L;
②发生反应:4NO2+O2+2H2O=4HNO3,4体积二氧化氮反应消耗1体积氧气,剩余3体积氧气,溶液体积等于5体积,则所得硝酸的浓度为$\frac{\frac{4VL}{22.4L/mol}}{5VL}$=0.8×$\frac{1}{22.4}$mol/L;
③中HCl溶解,溶液体积等于HCl的体积,所得盐酸的浓度为$\frac{\frac{VL}{22.4L/mol}}{VL}$=$\frac{1}{22.4}$mol/L;
④中氨气溶解,溶液体积等于氨气的体积,所得氨水的浓度为$\frac{\frac{VL}{22.4L/mol}}{VL}$=$\frac{1}{22.4}$mol/L,
故选:B.
点评 本题考查物质的量浓度的计算,关键是判断溶液体积与气体体积关系,侧重分析与计算能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
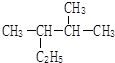 2,3-二甲基戊烷
2,3-二甲基戊烷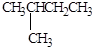

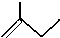 C5H10
C5H10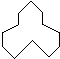 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | ①和②中溶质均未水解 | |
| B. | 由③④可得出酸性强弱关系:H2CO3>HF | |
| C. | ③中:c(Na+)+c(H+)=c(Fˉ)+c(OHˉ) | |
| D. | ④中:c(HCO3ˉ)+2c(CO32ˉ)+c(H2CO3)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
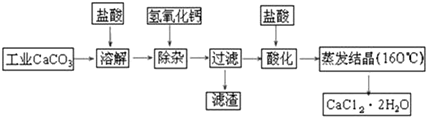
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯是纯净物,而氯水是混合物 | B. | 液氯有酸性,氯水有漂白性 | ||
| C. | 液氯较氯水的漂白作用更强 | D. | 液氯无色,氯水呈黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇是一种单糖,不能发生水解反应 | |
| B. | 木糖醇不属于糖类,它是多元醇 | |
| C. | 木糖醇易溶解于水,能发生酯化反应 | |
| D. | 1mol木糖醇与足量钠反应最多可产生2.5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com