
分析 (Ⅰ)(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;证明硫酸有剩余,需要证明溶液中有剩余的氢离子,根据硝酸根离子在酸性条件下具有强氧化性及氢离子能与碳酸盐反应进行分析;
(2)碱石灰能吸收二氧化硫和水;二氧化硫易溶于水,不能使用排水法测量气体体积;
(3)Cu2+与S2-反应生成黑色沉淀CuS,根据n=$\frac{m}{M}$计算出硫化铜的物质的量,从而得出铜离子的物质的量,再结合反应方程式计算出消耗硫酸的物质的量,然后根据硫酸的总物质的量计算出反应后溶液中硫酸的物质的量,最后根据c=$\frac{n}{V}$计算出剩余硫酸的浓度;
(Ⅱ)该白色沉淀为硫酸钡,说明二氧化硫被氧化成硫酸根离子,据此写出反应的离子方程式,证明了二氧化硫具有还原性.
解答 解:(Ⅰ)(1)在加热条件下,铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
硝酸根离子在酸性溶液中具有强氧化性,能够氧化金属铜,加入硝酸钠后,溶液中铜会继续溶解,则证明溶液中含有剩余的氢离子;即使没有余酸溶液中也有硫酸根离子,能与氯化钡反应生成沉淀,所以氯化钡溶液无法判断硫酸是否有剩余;稀硫酸与银不反应;氢离子能与碳酸盐反应,若有能使澄清的石灰水变浑浊的气体生成,则说明有余酸,所以ad正确,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;ad;
(2)碱石灰能吸收二氧化硫和水,故不能测出二氧化硫的质量;二氧化硫易溶于水,不能用排水法测体积,所以不可行的方案为ac,
故答案为:ac;
(3)Cu2+与S2-反应生成黑色沉淀:Cu2++S2-=CuS↓,则生成CuS的物质的量为:$\frac{Wg}{96g/mol}$=$\frac{W}{96}$mol,根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,反应消耗的硫酸的物质的量为:$\frac{W}{96}$mol×2=$\frac{W}{48}$mol,
20mL 18mol/L的浓硫酸中含有硫酸的物质的量为:18mol/L×0.02L=0.36mol,反应后的溶液中剩余硫酸的物质的量为:0.36mol-$\frac{W}{48}$mol,则剩余硫酸的物质的量浓度为:c=$\frac{0.36mol-\frac{W}{48}mol}{V×1{0}^{-3}L}$=$\frac{0.36-\frac{W}{48}}{V{×10}^{-3}}$ mol/L,
故答案为:$\frac{0.36-\frac{W}{48}}{V{×10}^{-3}}$;
(Ⅱ)先将产生的气体通过盛有饱和NaHSO3溶液的洗气瓶,再缓缓通入BaCl2溶液中,观察到有少量白色沉淀生成,检验白色沉淀,发现沉淀全部不溶于稀盐酸,说明生成的沉淀为BaSO4,发生反应为:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+,证明了二氧化硫具有还原性,
故答案为:还原;2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,明确实验目的为解答关键,注意掌握性质实验方案的设计原则及浓硫酸的性质,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>W | |
| B. | 四种元素一定属于短周期元素 | |
| C. | 最高价氧化物对应水化物的碱性:L>K | |
| D. | 原子序数:L>K>W>D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
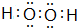 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
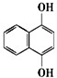 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )| A. | 2n=m | B. | n=m | C. | n+m=6 | D. | n+m=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸晶体(H2C2O4•2H2O)的工艺流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
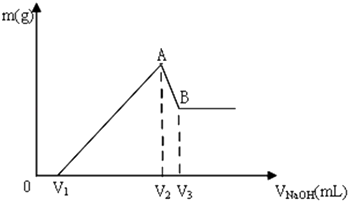
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
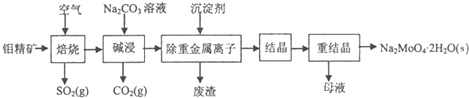
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com