
【题目】常温下,有0.1mol·L1的四种溶液:①CH3COOH②NH3·H2O③HCl④FeCl3
(1)用化学用语解释②呈碱性的原因:______。
(2)溶液③的pH=______。
(3)加热、蒸干、灼烧④后所得的产物是______。
(4)25℃时,向20mL①中不断滴入0.1mol·L1的NaOH溶液,混合溶液pH变化如图所示:
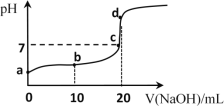
①a点水电离出的c(H+)______10-7mol·L1(填“大于”“小于”或“等于”)
②b点发生反应的离子方程式是______。
③c点溶液中存在的离子的浓度大小关系是______。
【答案】NH3·H2O![]() +OH- 1 Fe2O3 小于 CH3COOH+OH-=CH3COO-+H2O c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
+OH- 1 Fe2O3 小于 CH3COOH+OH-=CH3COO-+H2O c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
【解析】
根据电解质的电离分析;结合盐类水解的影响因素分析加热、蒸干、灼烧FeCl3溶液后所得的产物;根据酸碱中和原理并结合溶液中的电荷守恒和物料守恒分析解题。
(1) NH3·H2O是弱碱,在溶液中部分电离使溶液显碱性,其电离方程式为NH3·H2O![]() +OH-;
+OH-;
(2) 0.1mol·L1的HCl溶液中c(H+)=0.1mol·L1,则溶液pH=1;
(3) FeCl3溶液中存在Fe3+的水解平衡:Fe3++3H2OFe(OH)3+3H+,加热促水解,且同时生成的HCl挥发,故加热、蒸干得到Fe(OH)3固体,再灼烧Fe(OH)3分解生成Fe2O3,最终所得固体为Fe2O3;
(4)①醋酸是弱酸,电离出的H+抑制水的电离,则a点水电离出的c(H+)小于10-7mol·L1;
②滴加NaOH溶液与醋酸发生中和反应,则b点发生反应的离子方程式是CH3COOH+OH-=CH3COO-+H2O;
③c点溶液pH=7,则c(H+)=c(OH-);另外溶液中存在电荷守恒式为c(Na+)+ c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),故c点溶液中存在的离子的浓度大小关系是c(Na+)=c(CH3COO-)>c(H+)=c(OH-)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列7种有机物:
①CH4 ②CH3C≡CCH3 ③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:
其中属于醇类的是___(填序号,下同),互为同系物的是___,能与金属钠反应的有___,互为同分异构体的是___。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3,利用红外光谱仪检测其中的某些基团,测得红外光谱如图,则肉桂酸甲酯的结构简式是___(不考虑立体异构)。

(3)碳原子数不大于10的烷烃中一氯代物只有一种结构的物质有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将浓度为![]()
![]() HF溶液加水不断稀释过程中,
HF溶液加水不断稀释过程中,![]() 保持不变,电离度变大,溶液中所有离子的浓度均变小
保持不变,电离度变大,溶液中所有离子的浓度均变小
B.![]() 时,将
时,将![]() 的一元强酸溶液与
的一元强酸溶液与![]() 的一元碱溶液等体积混合后,所得溶液呈酸性或中性
的一元碱溶液等体积混合后,所得溶液呈酸性或中性
C.![]()
![]()
![]() 溶液与
溶液与![]()
![]()
![]() 溶液等体积混合所得溶液中:
溶液等体积混合所得溶液中:![]()
D.对于沉淀溶解平衡![]() ,已知平衡常数
,已知平衡常数![]() ,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:
,AgCl的平衡常数大于AgI,则含AgCl和AgI固体的悬浊液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
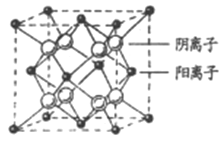
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
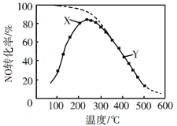
A.反应2NO(g)+O2(g)=2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K<2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是

A.1mol该烃完全燃烧消耗O2 11molB.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br2 3molD.分子中一定共平面的碳原子有6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com