
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
分析 烃W的相对分子质量为70,则有$\frac{70}{12}$=5…10,分子式应为C5H10,在W中滴加酸性高锰酸钾溶液,振荡,溶液褪色,说明W具有还原性,应含有C=C键,应为戊烯,以此解答该题.
解答 解:烃W的相对分子质量为70,则有$\frac{70}{12}$=5…10,分子式应为C5H10,在W中滴加酸性高锰酸钾溶液,振荡,溶液褪色,说明W具有还原性,应含有C=C键,应为戊烯,
A.分子式为C5H10,碳、氢质量比为5×12:10=6:1,故A错误;
B.相应烯烃有CH2═CH-CH2-CH2-CH3、CH3-CH═CH-CH2-CH3、CH2═C(CH3)CH2CH3、CH3C(CH3)═CHCH3、CH3CH(CH3)CH═CH2,共5种,故B正确;
C.如含4个甲基,则为 ,没有相应烯烃,故C错误;
,没有相应烯烃,故C错误;
D.如为CH3C(CH3)═CHCH3,含有3种H原子,H原子种类最少,为3个峰,故D错误.
故选B,
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重同分异构体的判断的考查,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
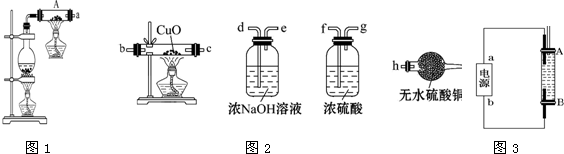
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
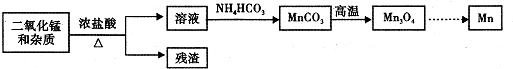
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2 s 内的平均反应速率υ(N2)=1.875×10-4 mol•L-1•s-1 | |
| B. | 在该温度下K=5 | |
| C. | 若将容积缩小为原来的一半,NO 转化率大于90% | |
| D. | 某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
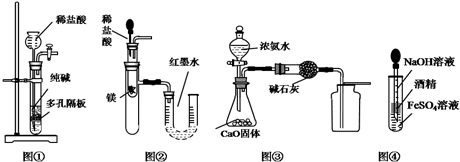
| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com