
| 对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
| 沸点/℃ | 138 | 144 | 139 | 80 |
| 熔点/℃ | 13 | -25 | -47 | 6 |
| A. | 该反应属于取代反应 | |
| B. | 甲苯的沸点高于144℃ | |
| C. | 用蒸馏的方法可将苯从反应所得产物中首先分离出来 | |
| D. | 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 |
分析 A、甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应;
B、甲苯的相对分子质量比二甲苯小,沸点比二甲苯低;
C、苯的沸点与二甲苯的沸点相差较大,用蒸馏的方法分离;
D、因为对二甲苯的熔点较高,将温度冷却至-25℃~13℃,对二甲苯形成固体,从而将对二甲苯分离出来.
解答 解:A、甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应,故A正确;
B、甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,故B错误;
C、苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,故C正确;
D、因为对二甲苯的熔点较高,将温度冷却至-25℃~13℃,对二甲苯形成固体,从而将对二甲苯分离出来,故D正确;
故选B.
点评 本题涉及到物质的分离和提纯、有机物的反应类型、沸点高低比较,考查学生根据表格的数据分析解决问题的能力,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 开发风能等洁净能源,减少使用化石燃料 | |
| B. | PM2.5表面积较大易吸附其他物质,对人体危害很大 | |
| C. | 雾霾严重时,中小学生应减少或停止户外活动 | |
| D. | 汽油标准由“国Ⅳ”提到“国 V”后,汽车不再排放氮氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
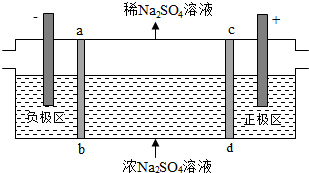
| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 负极反应为2H2O-4e-=O2+4H+,负极区溶液pH降低 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 充电时,电解质溶液中c(OH-)逐渐减小 | |
| C. | 放电时,负极反应为:Zn+4OH--2e-═Zn(OH)42- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
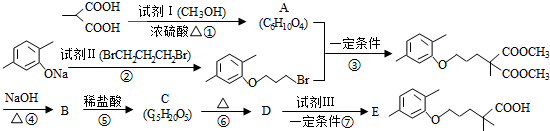
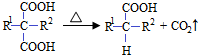 (R1和R2代表烷基)
(R1和R2代表烷基)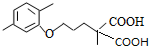 $\stackrel{加热}{→}$
$\stackrel{加热}{→}$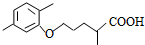 +CO2↑.
+CO2↑.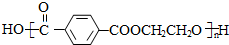 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
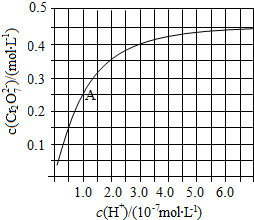 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com