
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是________________________________________________________________________
________________________________________________________________________。
(2)易与C发生化学反应的酸是________(写名称),反应的化学方程式是________________________________________________________________________。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:_____________________________________
________________________________________________________________________。
②要将纯碱高温熔化,下列坩埚中可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,
100 g混合物中石灰石的质量分数是____________________。
答案 (1)ⅣA 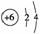 最外层均有4个电子,最内层均有2个电子
最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO2+4HF===SiF4↑+2H2O
(3)①SiO2+Na2CO3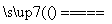 Na2SiO3+CO2↑,Na2SiO3+CO2+H
Na2SiO3+CO2↑,Na2SiO3+CO2+H 2O===Na2CO3+H2SiO3↓ ②D
2O===Na2CO3+H2SiO3↓ ②D
(4)50%
解析 (1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,C为SiO2,D为Na2SiO3。比硅相对原子质量小的同族元素B为碳。(2)C为SiO2,能与SiO2反应的酸只有氢氟酸。(3)SiO2与Na2CO3高温下反应生成Na2SiO3和CO2,含SiO2的材料(普通玻璃、石英玻璃)以及Al2O3等都能与Na2CO3在高温下反应,故不能用以上材质的坩埚熔融Na2CO3。(4)若SiO2恰好完全反应或过量,与CaCO3反应的化学方程式只有一个,即CaCO3+SiO2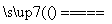 CaSiO3+CO2↑。若CaCO3过量,除发生上述反应外,还会发生反
CaSiO3+CO2↑。若CaCO3过量,除发生上述反应外,还会发生反 应:CaCO3
应:CaCO3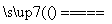 CaO+CO2↑。总之,CaCO3的多少决定了CO2的产量,可通过以下关系列式求解:
CaO+CO2↑。总之,CaCO3的多少决定了CO2的产量,可通过以下关系列式求解:
CaCO3 ~ CO2
100 g 22.4 L
m(CaCO3) 11.2 L
m(CaCO3)=50 g
混合物中CaCO3的质量分数: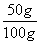 ×100%=50%。
×100%=50%。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
下列各组中两种气体所含的原子数一定相等的是:
 A.温度相同,体积相同的O2和N2
A.温度相同,体积相同的O2和N2
B.质量相等,密度不等的N2和CO
 C.体积相等,密度相等的CO和C2H4
C.体积相等,密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | ⑾ | ⑿ | ⒀ |
(1)元素 的单质室温下呈液态;元素 的氢化物最稳定;元素 的最高价氧化物的水化物的酸性最强;元素 的高价氧化物的水化物的碱性最强(填写“元素符号”);
(2)表中元素③与⑨形成稳定化合物的结构式是 ;
(3)表中元素①③⑤组成的“A4B2C2”型物质,分子内含有的键型是 ;
A.离子键和共价键 B.仅为共价键
C.仅为极性共价键 D.极性共价键和非极性共价键
(4)表中元素 的氢化物的分子间存在氢键(填写“数字序号”);
查看答案和解析>>
科目:高中化学 来源: 题型:
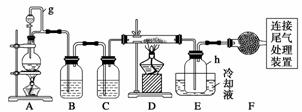
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________________________ ______
______
________________________________________________________________________。
(2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是________________________________________________________
________________________________________________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是 ( )
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
胡妥油(D)用作香料的原料,它可由A合成得到:

下列说法正确的是
A.若有机物A是由异戊二烯和丙烯酸加热得到的,则该反应的反应类型属于加成反应
B.有机物B 既能与O2催化氧化生成醛,又能跟NaHCO3溶液反应放出CO2气体
C.有机物C 的所有同分异构体中不可能有芳香族化合物存在
D.有机物D分子中所有碳原子一定共面
查看答案和解析>>
科目:高中化学 来源: 题型:
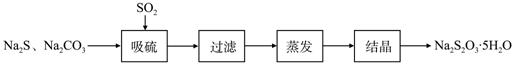
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2 (该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
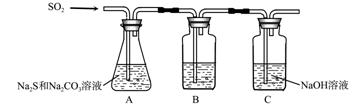 (1)吸硫装置如图所示。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+=== 2Cr3++3I2+7H2O 2S2O32-+I2===S4O62-+2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有下列各离子组的溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯化氢:Ca2+、K+、NO 、Cl-
、Cl-
B.氯气:Na+、Al3+、Br-、SO
C.乙烯:K+、H+、SO 、MnO
、MnO
D.氨气:Ag+、Fe3+、Na+、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质之间的转化关系,A、C、E、G为非金属单质,其中A、G在常温常压下为气体,E遇淀粉变蓝,K是一种常用的食品添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃)。

(1)B、I代表的物质的化学式分别为______________、______________。
(2)写出反应①、②的离子方程式:
①________________________________________________________________________;
②________________________________________________________________________。
(3)选出实验室保存C单质的注意事项________(A.无色瓶 B.棕色瓶 C.橡胶塞 D.玻璃塞),除此之外还采取了什么特殊的保存方法:__________________________。
(4)已知A、C、E均能与G反应,其反应条件要求由高到低的顺序为________________(用化学式表示)。
(5)A与H溶液反应,其氧化产物和还原产物的物质的量之比为1∶1,写出此反应的化学方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com