
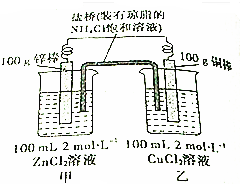
分析 锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,结合电极方程式解答该题.
解答 解:(1)锌为负极,被氧化,则锌棒质量减小,故答案为:锌;
(2)铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)反应过程中,当一电极质量增加2g,应为正极,则转移电子的物质的量为$\frac{2}{64}×2$mol=$\frac{1}{16}$mol,负极质量减少$\frac{1}{16}×65$×$\frac{1}{2}$>2,故答案为:大于.
点评 本题考查了原电池原理和电极反应式的书写,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握原电池的工作原理.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
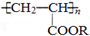 )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下一定深度处形成一个一定厚度的隔水层,既能阻止地下盐分的上升,又有拦截、蓄积雨水的作用.下列关于聚丙烯酸酯的说法正确的是( )| A. | 聚丙烯酸酯是混合物,没有固定的熔沸点 | |
| B. | 聚丙烯酸酯不能发生取代反应 | |
| C. | 聚丙烯酸酯和其单体(单体的结构式为CH2=CHCOOR)都能发生加成反应 | |
| D. | 合成聚丙烯酸酯的反应属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
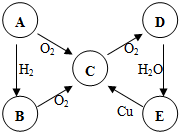 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式) B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
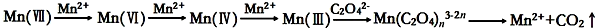
| 实验编号 | 烧杯中所加试剂及用量(mL) | 控制 条件 | 溶液褪色时间(S) | |||
| 0.10mol/LH2C2O4 溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65° | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL0.10mol/LK2SO4 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )| A. | A是反应物,B、C是生成物 | |
| B. | 前2 min A的分解速率为0.1 mol•L-1•min-1 | |
| C. | 前2 min C的生成速率为0.05 mol•L-1•min-1 | |
| D. | 反应的方程式为:2A(g)=2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
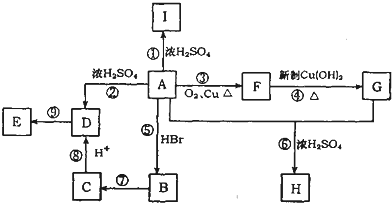
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: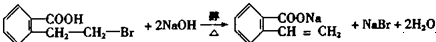 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com