
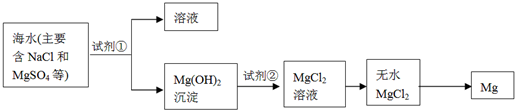
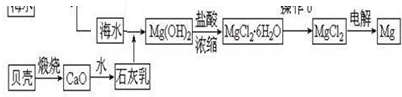
分析 根据题中工业流程图可知,海水中加入碱,使镁离子沉淀,得到氢氧化镁,氢氧化镁溶于盐酸得氯化镁溶液,氯化镁溶液在酸性条件下蒸发得无水氯化镁,电解熔融的氯化镁可得镁.
(1)粗盐提纯的主要步骤是:溶解、过滤、蒸发;
(2)①利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂;
②利用复分解反应及Mg(OH)2转化为MgCl2时阴离子的变化来选择试剂;
③MgO的熔点高,制备镁一般利用电解熔融的MgCl2;
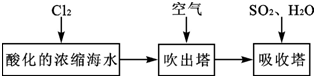
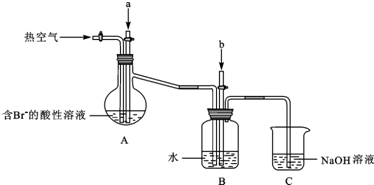
(3)由流程可知,氯气与浓缩海水中溴离子发生氧化还原反应生成溴,在吹出塔中富集溴,然后在吸收塔中溴、二氧化硫和水发生氧化还原反应生成硫酸和HBr;由实验装置可知,a为氯气,可氧化溴离子,热空气可将生成的溴蒸气吹出,气体b为二氧化硫,在B装置中发生氧化还原反应生成硫酸和HBr,C装置为尾气处理装置,吸收氯气、二氧化硫、溴等,以此来解答.
解答 解:(1)海水晒盐可获得粗盐,粗盐提纯的主要步骤是:溶解、过滤、蒸发,在实验室中粗盐经过溶解、过滤、蒸发得到溶质固体,
故答案为:过滤,蒸发;
(2)①使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择过量的NaOH,故答案为:氢氧化钠溶液,过量;
②Mg(OH)2转化为MgCl2时,酸能溶解沉淀,由阴离子可知,试剂②可以选用盐酸,故答案为:盐酸;
③MgO的熔点高,不能利用电解或还原法来制备镁,则ABD错误;适宜的冶镁方法是C,故答案为:C;
(3)①要想使溴离子变成溴单质,则加入的a能和溴离子发生反应生成溴单质,氯气能和溴离子发生置换反应生成溴单质,离子反应方程式为Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
②溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,故答案为:吹出Br2;
③使溴蒸气转化为氢溴酸以达到富集的目的,可知气体b为SO2,发生的反应为Br2+SO2+2H2O=2HBr+H2SO4,反应过程中,B装置中有SO42-生成.检验SO42-的方法是取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-,
故答案为:取少量B装置中反应后的溶液于试管中,滴加氯化钡溶液,产生白色沉淀,证明有SO42-;
④氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,可知C的作用为吸收未反应的Cl2、Br2和SO2,
故答案为:吸收未反应的Cl2、Br2和SO2.
点评 本题考查镁的制备,明确海水中镁的制备的流程及试剂的选择来分析解答,注意MgO的熔点高是学生解答中易忽略的地方,制备镁利用电解法,题目中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:选择题
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层为无色,下层为紫红色 D.下层无色,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 NH4Cl和0.1 mol•L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 向醋酸钠溶液中加入醋酸至溶液呈酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(H+)+c (Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
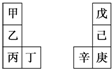 甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )
甲~辛等元素在周期表中的相对位置如表所示.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素.下列判断不正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| B. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:
某白色粉末其成分可能是Na2CO3和Na2SO3的一种或两种组成.请从下列的实验仪器及试剂中,选用合适的试剂和装置(夹持装置省略,试剂和装置可重复使用),完成对该白色粉末成分的探究装置:| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com