
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O的混合溶液浸取锌焙砂生成[Zn(NH3)4]2+的过程中加入H2O2的目的是________。
(2)加入(NH4)2S除杂过程中的主要离子方程式为________。
(3)过滤3所得滤液可循环使用,其主要成分的化学式是_______。
(4)检验2Zn(OH)2·ZnCO3沉淀是否洗涤干净的方法是________。
(5)写出沉锌步骤中发生反应的化学方程式________。
【答案】将Mn2+氧化为MnO2除去Cu2++S2-=CuS↓(NH4)2SO4取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则沉淀已洗涤干净3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O
【解析】
制备2Zn(OH)2·ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,过滤得2Zn(OH)2·ZnCO3,滤液为硫酸铵溶液,据此解答。
(1)双氧水具有强氧化性,还原产物是水,不会引入新杂质,因此加入H2O2的目的是将锰离子氧化成二氧化锰而除去锰;
(2)根据以上分析可知加入(NH4)2S的目的是除去铜离子,则除杂过程中的主要离子方程式为Cu2++S2-=CuS↓;
(3)根据上面的分析可知,过滤3所得滤液为硫酸铵溶液,(NH4)2SO4可以循环使用;
(4)根据上面的分析可知,过滤3所得滤液为硫酸铵溶液,因此证明2Zn(OH)2·ZnCO3沉淀洗涤完全即证明沉淀洗涤滤液中有没有硫酸根离子,所以操作为取最后一次洗涤液少许于试管中,滴加稀盐酸和BaCl2溶液,若无明显现象,则沉淀已洗涤干净;
(5)加入碳酸氢铵得到2Zn(OH)2·ZnCO3和二氧化碳气体,根据原子守恒可知还有硫酸铵和水生成,则沉锌步骤中发生反应的化学方程式为3ZnSO4+6NH4HCO3=2Zn(OH)2·ZnCO3↓+5CO2↑+3(NH4)2SO4+H2O。


科目:高中化学 来源: 题型:
【题目】有机物F(Bisphenol A dimethacrylate)是一种交联单体。合成F的一种路线如下:
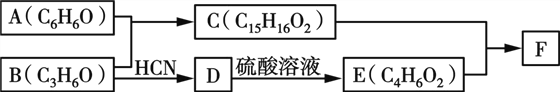
已知:
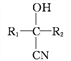
①![]() +HCN
+HCN![]()
②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A与B反应的化学方程式为________________。
(2)B→D的反应类型为____,E的结构简式为________。
(3)F的结构简式为____________。
(4)C的同分异构体中含有萘环(![]() )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱有8组峰的是____________(写出其中一种的结构简式)。
(5)A经如下步骤可合成环己烯甲酸:
A![]() G
G![]() H
H![]() I
I![]()
![]()
反应条件1为________;反应条件2为______;反应条件3所选择的试剂为____;I的结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,若合金全部溶解,向所得溶液中滴加10.0 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液体积的关系如下图所示。

(1)当加入NaOH溶液80mL到90mL时,发生反应的离子方程式为:_______________________________。
(2)当沉淀达到最大值时,其中Al(OH)3的质量为______________g;
(3)原盐酸的物质的量浓度为_______________mol/L;
(4)若所取盐酸的体积和浓度均保持不变,为保证加入100mL 10.0 mol/L NaOH溶液时最终无 Al(OH)3生成,则此时所取合金中含Al的物质的量即n(Al)的取值范围为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后褪色的原因。
(分析与猜想)根据过氧化钠与水反应的原理:![]() ,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会褪色,而实验中发现酚酞变红后又褪色。
,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会褪色,而实验中发现酚酞变红后又褪色。
(1)由此提出如下的猜想:
A.氧气有漂白性B B.氢氧化钠有漂白性 C.______
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质![]() ,
,![]() 的化学式是______。
的化学式是______。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是______(填选项,下同),②处装入的物质是______。
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是______,过氧化钠与水反应的化学方程式没有写出![]() 来,原因是______。
来,原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、
②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1 硝酸银溶液中,
其中Ag+浓度最小的是____________。(填序号)
(2)电解氯化钠可以得到多种化工原料。用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO![]() 等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO![]() ,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原为黑色的Pd)

(1)装置②中用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是_______。
A. H2SO4溶液 B. CCl4 C. 苯 D. 稀硝酸
(2)请将图中各装置按顺序连接(填装置接口字母):c接______,______接____,____接______,____接____。
(3)装置④的作用是__________。
(4)检查完装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到_________时再点燃酒精灯。
(5)若反应过程中CO2足量,钠与CO2充分反应后,生成的固体物质可能有多种情况,该同学提出以下猜想:
①生成的固体物质为Na2CO3
②生成的固体物质为Ns2CO3和C的混合物
③生成的固体物质为Ns2CO3和Na2O的混合物
④生成的固体物质为Ns2O和C的混合物
假如反应过程中有下列两种情况:
I. 观察到装置⑤PdCl2溶液中有黑色沉淀,若装置①中固体成分只有一种,且向固体中加入稀盐酸可产生能使澄清石灰水变浑浊的气体,写出该情况下钠与CO2反应的化学方程式____。
II. 装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入足量的稀盐酸中产生224ml(标准状况)CO2气体,溶液中残留固体的质量为___________。
(6)设计实验方案证明装置①中加入的金属钠部分被氧化____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol·L-1的某一元酸HA在水中有0.1%发生电离,下列说法不正确的是
A.该溶液pH=4
B.由HA电离出的c(H+)约为水电离的c(H+)的106倍
C.此酸的电离平衡常数约为1×10-7
D.升高温度,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 向稀盐酸溶液中加入铁粉:2Fe+6 H+![]() 2Fe3+ + 3H2↑
2Fe3+ + 3H2↑
C. 用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ ![]() Cu2+ + 2 Fe2+
Cu2+ + 2 Fe2+
D. 向氯化亚铁溶液中通入氯气:Fe2+ +Cl2=Fe3+ +2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中,正确的是
A. 以海水为原料制得精盐,再电解精盐的水溶液制取钠
B. 用海水、石灰乳等为原料,经一系列过程制得氧化镁,用H2还原氧化镁制得镁
C. 以铁矿石、焦炭、空气、石灰石等为原料,通过反应产生的CO在高温下还原铁矿石制得铁
D. 从铝土矿中获得氧化铝再制得氯化铝固体,电解熔融的氯化铝得到铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com