
”¾ĢāÄæ”æµŖ¼°Ęä»ÆŗĻĪļŌŚÉś²śÉś»īÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£
£Ø1£©ŅŃÖŖ£ŗCOæɽ«²æ·ÖµŖµÄŃõ»ÆĪļ»¹ŌĪŖN2”£
·“Ó¦¢ń£ŗ2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ”÷H = £746 kJ”¤mol£1
N2(g)+2CO2(g) ”÷H = £746 kJ”¤mol£1
·“Ó¦¢ņ£ŗ4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ”÷H = £1200 kJ”¤mol£1
N2(g)+4CO2(g) ”÷H = £1200 kJ”¤mol£1
Š“³öCO½«NO2»¹ŌĪŖNOµÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø2£©ŌŚŅ»¾ųČČŗćČŻµÄČŻĘ÷ÖŠ³äČė2mol COŗĶ1mol NO2·¢ÉśÉĻŹö·“Ó¦II£¬ŅŌĻĀÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ £Ø £©
A£®ČŻĘ÷ÄŚµÄ×ÜŃ¹Ēæ²»ŌŚ±ä»Æ B£®ČŻĘ÷ÄŚCOŗĶNO2ĪļÖŹµÄĮæ±Č²»±ä
C£®ČŻĘ÷ÄŚĘųĢåĘ½¾łĆÜ¶Č²»±ä D£®ČŻĘ÷ÄŚĘųĢåĪĀ¶Čŗć¶Ø²»±ä
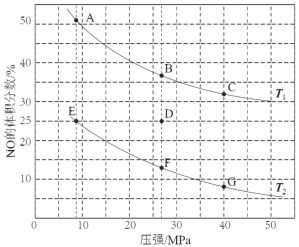
£Ø3£©ŌŚĆܱÕČŻĘ÷ÖŠ³äČė5 mol COŗĶ4 mol NO·¢ÉśÉĻŹö·“Ó¦I£¬ĻĀĶ¼ĪŖĘ½ŗāŹ±NOµÄĢå»ż·ÖŹżÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµ”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁĪĀ¶Č£ŗT1 T2£ØĢī”°£¼”±»ņ”°£¾”± £©”£
¢ŚÄ³ĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦½ųŠŠ10·ÖÖӷųöČČĮæ373 kJ£¬ÓĆCOµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(CO)= ”£
¢ŪČōŌŚDµć¶Ō·“ӦȯĘ÷ÉżĪĀµÄĶ¬Ź±Ą©“óĢå»żŹ¹ĢåĻµŃ¹Ēæ¼õŠ”£¬ÖŲŠĀ“ļµ½µÄĘ½ŗāדĢ¬æÉÄÜŹĒĶ¼ÖŠA~GµćÖŠµÄ µć
£Ø4£©Ä³ĪĀ¶ČŹ±£¬ŃĒĻõĖįŅųAgNO2µÄ Ksp= 9.0”Į10-4”¢Ag2SO4µÄKsp=4.0”Į10-5£¬µ±Ļņŗ¬NO2£”¢SO42£»ģŗĻČÜŅŗÖŠ¼ÓČėAgNO3ČÜŅŗÖĮSO42£Ē”ŗĆĶźČ«³Įµķ£Ø¼“SO42£ÅØ¶ČµČÓŚ1.0”Į10-5 mol”¤L-1£©Ź±£¬c(NO2£)= mol”¤L£1”£
£Ø5£©ČēÓŅĶ¼£¬ŌŚĖįŠŌĢõ¼žĻĀ£¬µē½āĖ®ÖŠCN-æÉ×Ŗ»ÆĪŖCO2ŗĶN2£¬ĒėŠ“³öŃō¼«µÄµē¼«·“Ó¦Ź½ ”£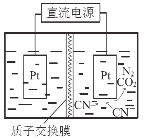
”¾“š°ø”æ£Ø1£©CO(g)+NO2(g)![]() CO2(g)+NO(g)”÷H=-227kJ”¤mol-1£»
CO2(g)+NO(g)”÷H=-227kJ”¤mol-1£»
£Ø2£©AD£»£Ø3£©¢Ł£¾£»¢Ś0.05mol”¤L-1”¤min-1£»¢ŪA£»
£Ø4£©4.5”Į10£4mol”¤L£1£»£Ø5£©2CN£+4H2O£10e-£½N2”ü+2CO2”ü+8H+”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©¢Ł2CO(g)+2NO(g) N2(g)+2CO2(g)£¬¢Ś4CO(g)+2NO2(g) N2(g)+4CO2(g)£¬(¢Ś£¢Ł)/2µĆ³öCO(g)+NO2(g)![]() CO2(g)+ NO(g) ”÷H= -227 kJ”¤mol-1£»£Ø2£©A”¢·“Ó¦Ē°ŗóĻµŹżÖ®ŗĶ²»ĻąµČ£¬Ņņ“ĖŃ¹Ēæ²»±ä£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹÕżČ·£»B”¢ŅņĪŖĶ¶ČėĮæĪŖ2£ŗ1£¬ÓėĻµŹżÖ®±ČĻąµČ£¬ČĪŗĪŹ±æĢ£¬ĪļÖŹµÄĮæÖ®±Č²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹Ź“ķĪó£»C”¢øł¾ŻĆܶȵĶØŅ壬×é·Ö¶¼ŹĒĘųĢ壬ĘųĢåÖŹĮæĻąµČ£¬ČŻĘ÷ŹĒŗćČŻ£¬ĘųĢåĢå»ż²»±ä£¬Ņņ“ĖĆÜ¶Č²»±ä£¬²»ÄÜĖµĆ÷“ļµ½Ę½ŗā£¬¹Ź“ķĪó£»D”¢ŅņĪŖ¾ųČČČŻĘ÷£¬Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĪĀ¶Č»įÉżøߣ¬µ±ĪĀ¶Č²»ŌŁøı䣬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹÕżČ·£»(3)¢Ł×÷µČŃ¹Ļߣ¬Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄ×Ŗ»ÆĀŹ½µµĶ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼“T1>T2£»¢ŚĻūŗÄ2molCO·Å³öČČĮæĪŖ746kJ£¬Ņņ“Ė·Å³ö373kJČČĮæĻūŗÄCOµÄĪļÖŹµÄĮæĪŖ2”Į373/746mol=1mol£¬øł¾Ż»Æѧ·“Ó¦ĖŁĀŹµÄ¶ØŅ壬v(CO)= 1/(2”Į10) mol”¤L-1”¤min-1=0.05 mol”¤L-1”¤min-1£»¢ŪÉżøßĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼“Aµć£»(4)µ±SO42£Č«²æ×Ŗ»Æ³É³Įµķ£¬“ĖŹ±ČÜŅŗµÄc2(Ag£«)=Ksp/c(SO42£)=4£¬¼“c(Ag£«)=2mol”¤L£1£¬Ņņ“Ėc(NO2£)=Ksp/c(Ag£«)=9”Į10£4/2mol”¤L£1=4.5”Į10£4mol”¤L£1£»(5)Ńō¼«ŹĒŹ§µē×ӵĹż³Ģ£¬»ÆŗĻ¼ŪÉżøߣ¬øł¾Ż×°ÖĆĶ¼£¬ÓŅ²ąµē¼«ĪŖŃō¼«£¬¼“µē¼«·“Ó¦Ź½ĪŖ£ŗ2CN£+4H2O£10e-£½N2”ü+2CO2”ü+8H+”£
CO2(g)+ NO(g) ”÷H= -227 kJ”¤mol-1£»£Ø2£©A”¢·“Ó¦Ē°ŗóĻµŹżÖ®ŗĶ²»ĻąµČ£¬Ņņ“ĖŃ¹Ēæ²»±ä£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹÕżČ·£»B”¢ŅņĪŖĶ¶ČėĮæĪŖ2£ŗ1£¬ÓėĻµŹżÖ®±ČĻąµČ£¬ČĪŗĪŹ±æĢ£¬ĪļÖŹµÄĮæÖ®±Č²»±ä£¬²»ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹Ź“ķĪó£»C”¢øł¾ŻĆܶȵĶØŅ壬×é·Ö¶¼ŹĒĘųĢ壬ĘųĢåÖŹĮæĻąµČ£¬ČŻĘ÷ŹĒŗćČŻ£¬ĘųĢåĢå»ż²»±ä£¬Ņņ“ĖĆÜ¶Č²»±ä£¬²»ÄÜĖµĆ÷“ļµ½Ę½ŗā£¬¹Ź“ķĪó£»D”¢ŅņĪŖ¾ųČČČŻĘ÷£¬Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĪĀ¶Č»įÉżøߣ¬µ±ĪĀ¶Č²»ŌŁøı䣬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗā£¬¹ŹÕżČ·£»(3)¢Ł×÷µČŃ¹Ļߣ¬Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄ×Ŗ»ÆĀŹ½µµĶ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼“T1>T2£»¢ŚĻūŗÄ2molCO·Å³öČČĮæĪŖ746kJ£¬Ņņ“Ė·Å³ö373kJČČĮæĻūŗÄCOµÄĪļÖŹµÄĮæĪŖ2”Į373/746mol=1mol£¬øł¾Ż»Æѧ·“Ó¦ĖŁĀŹµÄ¶ØŅ壬v(CO)= 1/(2”Į10) mol”¤L-1”¤min-1=0.05 mol”¤L-1”¤min-1£»¢ŪÉżøßĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼õŠ”Ń¹Ēæ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĢå»ż·ÖŹżŌö“󣬼“Aµć£»(4)µ±SO42£Č«²æ×Ŗ»Æ³É³Įµķ£¬“ĖŹ±ČÜŅŗµÄc2(Ag£«)=Ksp/c(SO42£)=4£¬¼“c(Ag£«)=2mol”¤L£1£¬Ņņ“Ėc(NO2£)=Ksp/c(Ag£«)=9”Į10£4/2mol”¤L£1=4.5”Į10£4mol”¤L£1£»(5)Ńō¼«ŹĒŹ§µē×ӵĹż³Ģ£¬»ÆŗĻ¼ŪÉżøߣ¬øł¾Ż×°ÖĆĶ¼£¬ÓŅ²ąµē¼«ĪŖŃō¼«£¬¼“µē¼«·“Ó¦Ź½ĪŖ£ŗ2CN£+4H2O£10e-£½N2”ü+2CO2”ü+8H+”£


 Ķ¬²½Į·Ļ°Ēæ»ÆĶŲÕ¹ĻµĮŠ“š°ø
Ķ¬²½Į·Ļ°Ēæ»ÆĶŲÕ¹ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆpHŹŌÖ½²ā¶ØijĪŽÉ«ČÜŅŗµÄpHŹ±£¬¹ę·¶µÄ²Ł×÷ŹĒ£Ø £©
A£®½«pHŹŌÖ½·ÅČėČÜŅŗÖŠ¹Ū²ģĘäŃÕÉ«±ä»Æ£¬øś±ź×¼±ČÉ«æØ±Č½Ļ
B£®½«ČÜŅŗµ¹ŌŚpHŹŌÖ½ÉĻ£¬øś±ź×¼±ČÉ«æØ±Č½Ļ
C£®ÓĆøÉŌļµÄ½ą¾»²£Į§°ōÕŗČ”ČÜŅŗ£¬µĪŌŚpHŹŌÖ½ÉĻ£¬øś±ź×¼±ČÉ«æØ±Č½Ļ
D£®ŌŚŹŌ¹ÜÄŚ·ÅČėÉŁĮæČÜŅŗ£¬Öó·Š£¬°ŃpHŹŌÖ½·ÅŌŚ¹ÜæŚ£¬¹Ū²ģŃÕÉ«£¬øś±ź×¼±ČÉ«æØ±Č½Ļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ£Ø £©
A£®ÓĆĶµē¼«µē½āĻõĖįŅųČÜŅŗ£ŗ4Ag++2H2O![]() 4Ag+O2”ü+4H+
4Ag+O2ӟ+4H+
B£®FeSÖŠ¼ÓČė×ćĮæĻ”ĻõĖį£ŗFeS+2H+=Fe2++H2”ü
C£®ŹÆ»ŅŹÆČÜÓŚ“×ĖįČÜŅŗÖŠ£ŗCaCO3+2H+=Ca2++H2O+CO2”ü
D£®³ĪĒåŹÆ»ŅĖ®ÖŠĶØČė¹żĮæµÄCO2£ŗCO2+OH©=HCO3©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫µČĪļÖŹµÄĮæµÄA”¢B»ģŗĻÓŚ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ
3A£Øg£©£«B£Øg£©![]() xC£Øg£©£«2D£Øg£©£¬¾5 minŗ󣬲āµĆDµÄÅضČĪŖ0.5 mol/L£¬
xC£Øg£©£«2D£Øg£©£¬¾5 minŗ󣬲āµĆDµÄÅضČĪŖ0.5 mol/L£¬
c£ØA£©”Ćc£ØB£©£½3”Ć5£¬CµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.1 mol/£ØL”¤min£©”£Ēó£ŗ
£Ø1£©“ĖŹ±AµÄÅضČc£ØA£©£½________mol/L£¬·“Ó¦æŖŹ¼Ē°ČŻĘ÷ÖŠµÄA”¢BµÄĪļÖŹµÄĮæ£ŗn£ØA£©£½n£ØB£©£½________mol£»
£Ø2£©BµÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØB£©£½________mol/£ØL”¤min£©£»
£Ø3£©xµÄÖµĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷ÖŠĖłÓĆŅĒĘ÷ŗĻĄķµÄŹĒ
A. ÓĆ100mLČŻĮæĘæÅäÖĘ70mL0.1mol/LŃĪĖį B. ÓĆĶŠÅĢĢģĘ½³ĘČ”25.20gĀČ»ÆÄĘ
C. ÓĆ20mLµÄĮæĶ²ĮæČ”13.86mL NaOHČÜŅŗ D. ÓĆÕō·¢Ćó¼ÓČČµØ·Æ¾§Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”澧Ģå¹čŹĒŅ»ÖÖÖŲŅŖµÄ·Ē½šŹō²ÄĮĻ£¬Öʱø“æ¹čµÄÖ÷ŅŖ²½ÖčČēĻĀ£ŗ
¢ŁøßĪĀĻĀÓĆĢ滹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č£»
¢Ś“Ö¹čÓėøÉŌļHClĘųĢå·“Ó¦ÖʵĆSiHCl3£ŗSi£«3HCl![]() SiHCl3£«H2£»
SiHCl3£«H2£»
¢ŪSiHCl3Óė¹żĮæH2ŌŚ1000”«1100 ”ę·“Ó¦ÖʵƓæ¹č”£
ŅŃÖŖ£ŗSiHCl3ÄÜÓėH2OĒæĮŅ·“Ó¦£¬ŌŚæÕĘųÖŠŅ××ŌČ¼”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µŚ¢Ł²½Öʱø“Ö¹čµÄ»Æѧ·½³ĢŹ½ĪŖ_____________________”£
£Ø2£©ÓĆSiHCl3Óė¹żĮæH2·“Ó¦Öʱø“æ¹čµÄ×°ÖĆČēĻĀ(ČČŌ“¼°¼Š³Ö×°ÖĆĀŌČ„):
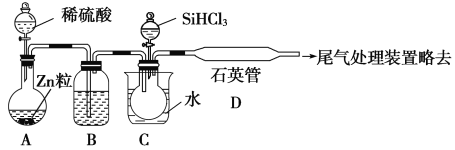
¢Ł×°ÖĆBÖŠµÄŹŌ¼ĮŹĒ________”£×°ÖĆCÖŠµÄÉÕĘæŠčŅŖ¼ÓČČ£¬ĘäÄæµÄŹĒ_________________”£
¢Ś·“Ó¦Ņ»¶ĪŹ±¼äŗó£¬×°ÖĆDÖŠ¹Ū²ģµ½µÄĻÖĻóŹĒ________________£¬×°ÖĆDÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________________________”£
¢ŪĪŖ±£Ö¤Öʱø“æ¹čŹµŃéµÄ³É¹¦£¬²Ł×÷µÄ¹Ų¼üŹĒ¼ģ²éŹµŃé×°ÖƵÄĘųĆÜŠŌ£¬æŲÖĘŗĆ·“Ó¦ĪĀ¶ČŅŌ¼°__________________________”£
¢ÜSiHCl3µÄµē×ÓŹ½ĪŖ________£¬SiHCl3ÓėH2O·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ_________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢E”¢FŹōÓŚ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£®AµÄŌ×Ó°ė¾¶ŹĒ¶ĢÖÜĘŚÖŠ×ī“ó£¬BŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżĪŖm”¢“ĪĶā²ćµē×ÓŹżĪŖn£¬CŌŖĖŲµÄŌ×ÓL²ćµē×ÓŹżĪŖm+n£¬ M²ćµē×ÓŹżĪŖm©n£¬DŌŖĖŲÓėCŌŖĖŲĶ¬Ö÷×壬EŌŖĖŲŌ×ÓÓėBŌŖĖŲŌ×ÓµÄŗĖĶāµē×ÓŹżÖ®±ČĪŖ2£ŗ1£¬FµÄŅ»ÖÖŌ×ÓÖŠ£¬ÖŹĮæŹżÓėÖŹ×ÓŹżÖ®²īĪŖĮć£®
£Ø1£©Š“³öŌŖĖŲµÄĆū³ĘC________E________F________.
£Ø2£©CŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ________
£Ø3£©A2B2µÄµē×ÓŹ½ĪŖ______£®
£Ø4£©A”¢BŠĪ³ÉµÄ¼ņµ„Ąė×ӵİė¾¶Óɓ󵽊”µÄĖ³ŠņĪŖ________£®£ØÓƶŌÓ¦µÄ»Æѧ·ūŗÅĢīæÕ£¬ĻĀĶ¬£©
£Ø5£©A”¢EŠĪ³ÉµÄŹĒ________£ØĢī¹²¼Ū»ņĄė×Ó£©»ÆŗĻĪļ
£Ø6£©B”¢EĮ½ÖÖŌŖĖŲŠĪ³ÉµÄĘųĢ¬Ēā»ÆĪļÖŠĪČ¶ØŠŌøüĒæµÄŹĒ______£»
£Ø7£©ÓÉŌŖĖŲCŠĪ³ÉµÄµ„ÖŹYÓėÓÉA”¢B”¢FČżÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļXµÄĖ®ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________________________________£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļAX3ŗĶµ„ÖŹX2ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æÉÉś³É»ÆŗĻĪļAX5”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅŃÖŖAX3µÄČŪµćŗĶ·Šµć·Ö±šĪŖ£93.6 ”ęŗĶ76 ”ę£¬AX5µÄČŪµćĪŖ167 ”ę”£ŹŅĪĀŹ±AX3ÓėĘųĢåX2·“Ӧɜ³É1 mol AX5£¬·Å³öČČĮæ123.8 kJ”£øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________”£
£Ø2£©·“Ó¦AX3£Øg£©£«X2£Øg£©===AX5£Øg£©ŌŚČŻ»żĪŖ10 LµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ĘšŹ¼Ź±AX3ŗĶX2¾łĪŖ0.2 mol”£·“Ó¦ŌŚ²»Ķ¬Ģõ¼žĻĀ½ųŠŠ£¬·“Ó¦ĢåĻµ×ÜŃ¹ĒæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
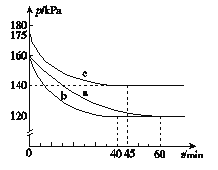
¢Ł ĮŠŹ½¼ĘĖ揵Ńéa“Ó·“Ó¦æŖŹ¼ÖĮ“ļµ½Ę½ŗāŹ±µÄ·“Ó¦ĖŁĀŹv£ØAX5£©£½__________”£
¢Ś Ķ¼ÖŠ3×鏵Ńé“Ó·“Ó¦æŖŹ¼ÖĮ“ļµ½Ę½ŗāŹ±µÄ·“Ó¦ĖŁĀŹv£ØAX5£©Óɓ󵽊”µÄ“ĪŠņĪŖ £ØĢīŹµŃéŠņŗÅ£©£»ÓėŹµŃéaĻą±Č£¬ŹµŃébøıäµÄŹµŃéĢõ¼ž¼°ÅŠ¶ĻŅĄ¾ŻŹĒ ”£
¢Ū ÓĆp0±ķŹ¾æŖŹ¼Ź±×ÜŃ¹Ē棬p±ķŹ¾Ę½ŗāŹ±×ÜŃ¹Ē棬¦Į±ķŹ¾AX3µÄĘ½ŗā×Ŗ»ÆĀŹ£¬Ōņ¦ĮµÄ±ķ“ļŹ½ĪŖ__________£»ŹµŃéaŗĶcµÄĘ½ŗā×Ŗ»ÆĀŹ£ŗ¦ĮaĪŖ________£¬¦ĮcĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŖĖŲXµÄŌ×Ó£¬ĘäM²ćÓėK²ćµē×ÓŹżĻąĶ¬£»ŌŖĖŲYµÄŌ×Ó£¬ĘäL²ćÉĻÓŠ5øöµē×Ó”£XŗĶYĖłŠĪ³ÉµÄĪČ¶Ø»ÆŗĻĪļµÄĦ¶ūÖŹĮæĪŖ
A£®148g”¤mol£1 B£®100g”¤mol£1 C£®90g”¤mol£1 D£®38g”¤mol£1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com