
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
| 步骤4:取适量步骤2得到的滤液, 先加入过量稀硝酸,然后加入硝酸银溶液 | 若产生白色沉淀,则酸雨中含有盐酸 |
| 步骤5:往B试管中加入少量品红溶液,振荡 | 若品红溶液褪色,则酸雨含有亚硫酸或二氧化硫 |


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、块状大理石和稀硫酸 |
| B、NH4Cl与稀NaOH溶液 |
| C、Na2O2与NaOH溶液 |
| D、铜片与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
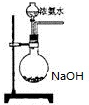 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室可通过蒸馏的方法,从含Fe3+的自来水中获得少量纯净水 |
| B、向样品中加入盐酸酸化的氯化钡溶液,以确定样品中是否含有SO42- |
| C、用洁净的玻璃棒蘸取待测液样品溶液置于酒精灯火焰上灼烧,检测是否含有Na+ |
| D、用干燥且洁净的玻璃棒蘸取待测溶液滴在湿润的pH试纸中部,跟标准比色卡对照可测定溶液的pH值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com