
| A. | 5.6L | B. | 11.2L | C. | 22.4L | D. | 44.8L |
分析 加热发生反应Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,再根据V=nVm计算生成气体的体积.
解答 解:加热发生反应Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$FeS,加入盐酸一定发生反应FeS+2HCl=FeCl2+H2S↑,而Fe与盐酸反应为Fe+2HCl=FeCl2+H2↑,
由方程式可知加热过程中Fe无论过量与否,与盐酸反应最终得到的气体的物质的量等于原混合物中Fe的物质的量,
所以生成气体物质的量为:n(气体)=n(Fe)=$\frac{56g}{56g/mol}$=1mol,气体体积为1mol×22.4L/mol=22.4L,
故选C.
点评 本题考查化学方程式的计算,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
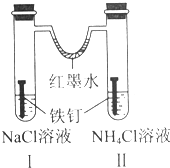
| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液滴入硫酸中:Ba2++SO42-→BaSO4↓ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+→Cu2++Ag | |
| C. | 醋酸加入氢氧化钠溶液中:H++OH-→H2O | |
| D. | 氯化铁溶液中滴入氢氧化钾溶液:Fe3++3OH-→Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-═2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝是地壳中含量最多的元素 | B. | 铁是人类冶炼最多的金属 | ||
| C. | 汞是所有金属中熔点最低的 | D. | 钙是人体内最多的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
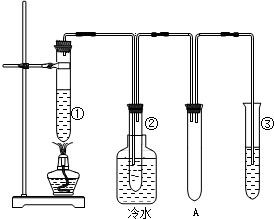 石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示.在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
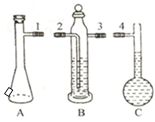 在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.
在“测定1mol气体体积”实验中,我们通常选择的测量气体是氢气,选择的反应原理是镁和稀硫酸反应.| 实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
| 1 | 0.108 | 10.0 | 129.2 | 8.0 |
| 2 | 0.105 | 10.0 | 125.7 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质) | |
| B. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) | |
| C. | 液氨(氢化物)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) | |
| D. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com