
已知电离平衡常数:H2CO3>HClO>HCO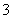 ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是 ( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO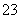
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
科目:高中化学 来源: 题型:
已知,在热的碱性溶液中NaClO能发生如下反应:3NaClO—→2NaCl+NaClO3 。在相同条件下NaClO2也能发生类似反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH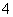 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO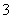 、SO
、SO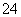 、CO
、CO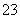 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为________________,D溶液显碱性的原因是_____________________(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______________________________________;
E和氨水反应的离子方程式是____________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+ 、Na+、Fe2+、MnO4-
、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3- D .K+、NH4+、OH-、SO42-
.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,错误的是( )
A.向NaAlO2溶液中通入过量的CO2:
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.向硫酸亚铁溶液中加入氯水:
2Fe2++Cl2=2Fe3++2Cl-
C.碳酸氢钡溶液中加入过量氢氧化钠溶液:
Ba2++2HCO3-+2OH-=BaCO3↓+2H2O+CO32-
D.Fe2O3溶于过量的氢碘酸:
Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13 mol·L-1时又能生成沉淀。则该组离子可能是 ( )
A.Na+、Ba2+、NO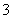 、CO
、CO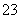
B.Ba2+、K+、Cl-、NO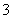
C.Mg2+、NH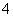 、SO
、SO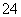 、Cl-
、Cl-
D.Fe2+、Na+、SO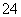 、NO
、NO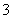
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com