
| A. | Y在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是两种不同的核素 | |
| D. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为50 |
分析 Y元素为39号元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的数字表示电子层数,价电子是4d15S 2,价电子数之和=族序数,所以Y属第五周期第ⅢB族,由此分析解答.
解答 解:Y元素为39号元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的数字表示电子层数,价电子是4d15S 2,价电子数之和=族序数,所以Y属第五周期第ⅢB族.
A、钇在周期表中的位置是第五周期第ⅢB族,故A错误;
B、该元素是副族元素,所以是金属元素,故B错误;
C、${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是质子数相同,中子数相同的同一元素,所以是不同的两种核素,故C正确;
D、素${\;}_{39}^{89}$Y的质子数为39,质量数为89,中子数=质量数-质子数=89-39=50,质子数与中子数之差为-11,故D错误;
故选C.
点评 本题考查了原子符号的含义、质子数、中子数、电子数之间的计算以及核素的定义,难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
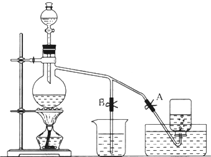 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
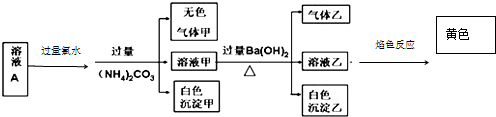
| A. | 沉淀乙一定可溶于盐酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定没有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 气体甲、乙均为无色、有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是非金属元素 | |
| B. | X形成含氧酸钾盐化学式可能为KXO2、KXO3或KXO4 | |
| C. | 由X形成的含氧酸均为强酸 | |
| D. | X不可能为第一周期元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com