

| A. | 该有机物的分子式为C11H14O3 | |
| B. | 该有机物可能易溶于水且具有水果香味 | |
| C. | 该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代 | |
| D. | 1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应 |
分析 A.该分子中含有11个碳原子、12个H原子、3个O原子;
B.该物质中含有碳碳双键、羧基、醇羟基和苯环,没有酯基;
C.该物质中含有碳碳双键、羧基、醇羟基和苯环,具有烯烃、羧酸、醇和苯的性质;
D.苯环和碳碳双键能和氢气在一定条件下发生加成反应.
解答 解:A.该分子中含有11个碳原子、12个H原子、3个O原子,其分子式为C11H12O3,故A错误;
B.该物质中含有碳碳双键、羧基、醇羟基和苯环,没有酯基,所以没有水果香味,故B错误;
C.该物质中含有碳碳双键、羧基、醇羟基和苯环,具有烯烃、羧酸、醇和苯的性质,醇羟基、碳碳双键都能发生氧化反应,醇羟基能发生酯化反应和取代反应,没有酯基或卤原子,所以不能发生水解反应,故C错误;
D.苯环和碳碳双键能和氢气在一定条件下发生加成反应,则1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、烯烃及羧酸的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰的晶体中每个水分子可与周围两个水分子形成氢键 | |
| B. | 手性碳原子不一定是饱和碳原子 | |
| C. | 区分晶体与非晶体最科学的方法是X-射线衍射法 | |
| D. | 晶体中有阳离子就一定有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
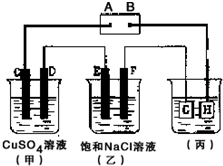 如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:
如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液能使紫色石蕊溶液变红 | |
| B. | 醋酸溶液能与碳酸钠反应产生二氧化碳气体 | |
| C. | 煮沸醋酸溶液再冷却到常温,发现溶液pH变大 | |
| D. | 浓度均为1mol/L的盐酸和醋酸,前者导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
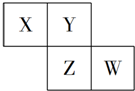 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,若W原子的最外层电子数是内层电子总数的$\frac{7}{10}$,下列说法中正确的是( )| A. | 阴离子的半径从大到小排列顺序为:X>Y>Z>W | |
| B. | X、Y、Z、W元素的氢化物分子间都可以形成氢键 | |
| C. | Y的两种同素异形体在常温下可以相互转化 | |
| D. | 最高价氧化物对应的水化物的酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| B. | 铜片与稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O | |
| C. | Fe2(SO4)3的酸性溶液中通入足量硫化氢Fe3++H2S=Fe2++S↓+2H+ | |
| D. | 在碳酸氢钙溶液中加入过量氢氧化钠溶液Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com