
分析 (1)在水溶液里或熔融态下能够导电的化合物叫做电解质,主要包括酸、碱、盐、氧化物等;
(2)强酸和强碱发生中和反应生成可溶性盐和水的离子方程式为H++OH-=H2O.
解答 解:(i)⑤H2SO4、⑥Ba(OH)2、⑨HCl、⑩Al2(SO4)3在水溶液里能够发生电离而使溶液导电,是电解质,①H2、②铜是单质,⑦红褐色的氢氧化铁胶体、⑧氨水是混合物,不是化合物,既不是电解质也不是非电解质,③酒精、④CO2是非电解质,
故答案为:⑤⑥⑨⑩;
(ii)强酸和强碱发生中和反应生成可溶性盐和水的离子方程式为H++OH-=H2O,因此该反应为2HCl+Ba(OH)2═BaCl2+2H2O,
故答案为:2HCl+Ba(OH)2═BaCl2+2H2O.
点评 本题考查了电解质、离子反应,题目难度不大,注意单质和混合物既不是电解质也不是非电解质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、H+、Ag+ | B. | K+、Fe3+、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、CO32- | D. | Na+、AlO2-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料及汽车尾气是造成雾霾天气的重要因素 | |
| B. | 冬天严禁在窗门紧闭的室内用煤饼炉取暖,因为生成的CO、SO2等容易引起中毒 | |
| C. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全地带 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 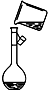 向容量瓶中转移溶液 | B. | 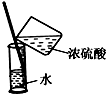 稀释浓硫酸 | ||
| C. | 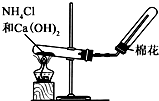 制取氨气 | D. | 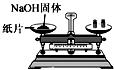 称取NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 糖类、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| D. | 明矾可以用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O | D. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com