
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)2NH3(g)
ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
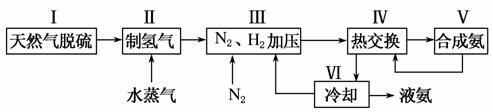
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_____________________________________________________ _____________________________________________________________________________________。
(2)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g)
ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________(填选项字母)。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为______________________ __________________________________________________。
(3)图1表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为________。
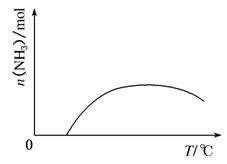
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法________________________________________________________________________。
解析 (1)向NH4HS溶液中通入空气,发生氧化还原反应,有S单质生成,故反应为2NH4HS+O2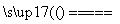 2NH3·H2O+2S↓
2NH3·H2O+2S↓
(2)反应①是一个吸热反应,升高温度平衡正向移动,将会增加H2的含量,同时提高反应速率;增大水蒸气的浓度,会提高反应速率,但H2的含量会降低;加入催化剂,不会引起H2含量的改变;降低压强,反应速率减小;故a正确。设CO反应掉n mol。
CO(g)+H2O(g)CO2(g)+H2(g)
投入量/mol 0.2 0 0.8
变化量/mol n n n
最终量/mol 0.2-n n 0.8+n
则:0.2-n+n+0.8+n=1.18 解得:n=0.18
CO的转化率为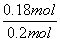 ×100%=90%。
×100%=90%。
(3)设投入N2和H2的物质的量分别是1 mol、3 mol,平衡时N2反应掉m  mol。
mol。
N2 + 3H22NH3
起始量/mol 1 3 0
变化量/mol m 3m 2m
平衡量/mol 1-m 3-3m 2m
根据题意: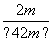 =42%,解得m≈0.59,所以平衡时N2的体积分数为
=42%,解得m≈0.59,所以平衡时N2的体积分数为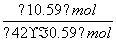 ×100%≈14.5%。
×100%≈14.5%。
(4)通入原料气,反应开始,氨气的量增加,因为合成氨是一个放热反应,当达到平衡后温度升高,氨气的含量将减小。所以图象为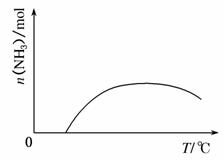 。
。
(5)从流程图看,反应放出的能量得到充分利用是在热交换器中。提高合成氨原料转化率的方法是:将未反应的原料重新送回反应器中循环使用、对原料气加压。
答案 (1)2NH4HS+O2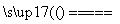 2NH3·H2O+2S↓
2NH3·H2O+2S↓
(2)a 90%
(3)14.5%
(4)
(5)Ⅳ 对原料气加压;分离液氨后,未反应的N2、H2循环使用


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.100 mL 0.1 mol/L K2SO4溶液中,含有氧原子数为0.04 NA
B.100 g 17%的氨水中,含有氨分子数为NA
C.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
D.25 ℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
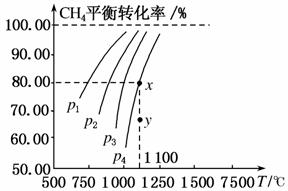
在一恒容的密闭容器中充入0.1 mol/L CO2、0.1 mol/L CH4,在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1 100 ℃时该反应平衡常数为1.64
D.压强为p4时,在y点:v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO >Y->X->HCO
>Y->X->HCO
D.HX和HY酸性相同,都比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)。
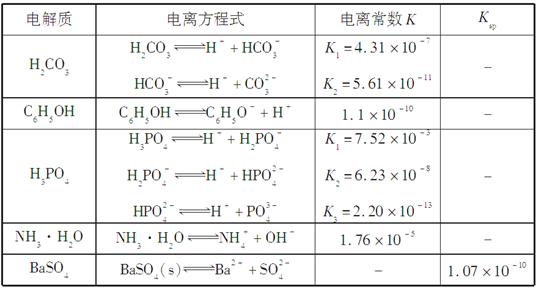
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式______________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填选项字母)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH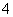 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH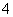 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kh=________
mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
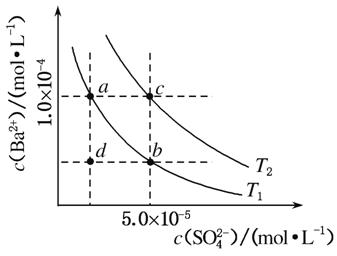
①T2________25 ℃(填“>”“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填选项字母)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.比例模型 :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
B.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+) =1×10-5 mol/L
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和
1×10-4 mol·L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
A. 2Na + 2H2O ==2NaOH + H2↑ B. CH4 + 2O2==CO2 + 2H2O
C. KClO3==2KCl + 3O2↑ D. CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com