
| A. | 1.7g的OH-中含有的电子数为NA | |
| B. | 常温常压下,1.12LO2中所含氧原子数为NA | |
| C. | 0.1molNa2O2中含O2-数为0.2NA | |
| D. | 1L1mol/LH2SO4中,含有总离子数为3NA |
分析 A.求出OH-的物质的量,然后根据OH-中含10个电子来分析;
B.常温常压Vm≠22.4L/mol;
C.过氧化钠阴离子为过氧根离子;
D.硫酸溶液中水也电离产生氢离子.
解答 解:A.1.7gOH-的物质的量为0.1mol,而OH-中含10个电子,故0.1molOH-中含1mol电子即NA个,故A正确;
B.常温常压Vm≠22.4L/mol,无法计算1.12LO2物质的量,故B错误;
C.0.1molNa2O2中含O2-数为0.1NA,故C错误;
D.硫酸溶液中水也电离产生氢离子,所以1L1mol/LH2SO4中,含有总离子数大于3NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用及有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,还要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积使用条件和对象.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
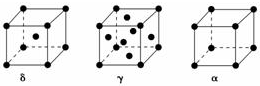 过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:
过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
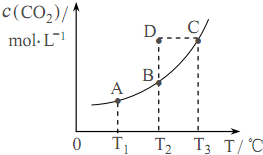 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
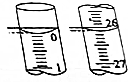 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与盐酸恰好中和后的溶液:c(H+)>c(OH-) | |
| B. | 0.2mol/L醋酸溶液与0.1mol/L NaOH溶液等体积混合后的溶液:c(CH3COO-)+c(CH3COOH)=0.2mol/L | |
| C. | NaHSO3溶液(呈酸性):c(Na+)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | NaHSO4溶液滴入氨水后的溶液:c(H+)+c(NH4+)=2c(SO42-)+c(OH-). |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
用下列实验装置完成对应的实验(部分仪器已省略》,能达到实验目的的是(已知HCl、NH3是极易溶于水的气体)
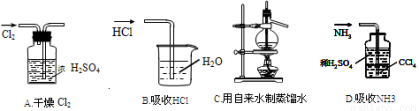
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com