
”¾ĢāÄæ”æNaClO2¹ć·ŗÓĆÓŚŌģÖ½¹¤Ņµ”¢ĪŪĖ®“¦ĄķµČ£¬ĘäĘÆ°×ÄÜĮ¦ŹĒĘÆ°×·ŪµÄ4”«5±¶£¬¹¤ŅµÉĻÓĆC1O2ĘųĢåÖĘNaClO2µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

¼ŗÖŖ£ŗNaClO2±„ŗĶČÜŅŗŌŚµĶÓŚ38”ꏱĪö³öNaC1O2”¤3H2O£¬øßÓŚ38”ꏱĪö³öNaClO2
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ĪüŹÕĘ÷ÖŠÉś³ÉNaClO2µÄĄė×Ó·½³ĢŹ½£ŗ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. Į÷³ĢÖŠµÄ½į¾§”¢¹żĀĖ²Ł×÷Ó¦øĆŹĒÕō·¢½į¾§”¢³ĆČČ¹żĀĖ
C. ĢįøßĪüŹÕĘ÷ÖŠµÄ·“Ó¦ĪĀ¶ČæÉŅŌĢįøß·“Ó¦ĖŁĀŹ£¬Ņ²Ģįøß·“Ó¦ĪļµÄĄūÓĆĀŹ
D. ·¢ÉśĘ÷ÖŠ·“Ó¦½įŹųŗó£¬ĻņĘäÖŠĶØČėŅ»¶ØĮææÕĘųµÄÄæµÄŹĒĒżøĻ³öClO2£¬Ź¹Ęä±»³ä·ÖĪüŹÕ
”¾“š°ø”æC
”¾½āĪö”æĪüŹÕĘ÷ÖŠ¶žŃõ»ÆĀČ”¢ĒāŃõ»ÆÄĘ”¢Ė«ŃõĖ®·“Ӧɜ³ÉNaClO2£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O£¬¹ŹAÕżČ·£»µĶÓŚ38”ꏱĪö³öNaC1O2”¤3H2O£¬ĖłŅŌŅŖµĆµ½NaClO2£¬ŠčŅŖÕō·¢½į¾§”¢³ĆČČ¹żĀĖ£¬¹ŹBÕżČ·£»ĪĀ¶ČÉżøßĖ«ŃõĖ®·Ö½ā£¬½µµĶĢįøß·“Ó¦ĪļµÄĄūÓĆĀŹ£¬¹ŹC“ķĪó£»ĶØČėŅ»¶ØĮææÕĘųæÉŅŌĒżøĻ³öClO2£¬Ź¹Ęä±»³ä·ÖĪüŹÕ£¬¹ŹDÕżČ·”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŹŌ¹ÜÖŠŹ¢ÓŠµāµÄĖ®ČÜŅŗ£¬¼ÓČėÉŁĮæµÄCCl4£¬³ä·ÖÕńµ“£¬¾²ÖĆʬæĢŗó
A. ÕūøöČÜŅŗ±äĄ¶É« B. ÉĻ²ćĪŽÉ«ĻĀ²ć×ĻŗģÉ«
C. ÕūøöČÜŅŗĻŌ×ĻŗģÉ« D. ÉĻ²ć×ĻŗģÉ«ĻĀ²ćĪŽÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ×é³ÉÓńĆ×ŗĶČĖĢåĻø°ūÖŠ×ī»ł±¾µÄŌŖĖŲŹĒ
A.Ģ¼B.ĒāC.ŃõD.µŖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖij±„ŗĶNaClČÜŅŗµÄĢå»żĪŖVmL£¬ĆܶČĪŖ¦Ńg/cm3£¬ÖŹĮæ·ÖŹżĪŖw%£¬ĪļÖŹµÄĮæÅضČĪŖcmol/L£¬ČÜŅŗÖŠŗ¬NaClµÄÖŹĮæĪŖmg”£ŌņĻĀĮŠ±ķ“ļŹ½ÕżČ·µÄŹĒ
A. n(NaCl)=¦ŃV/58.5 B. c(NaCl)=10¦Ńw/58.5 C. w=m/¦ŃV D. V=22.4m/58.5
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«0.1L0.1mol/L Na2S2O3ČÜŅŗÓėŅ»¶ØĮæµÄpH=2µÄĮņĖįČÜŅŗ»ģŗĻ£¬·Å³öVLĘųĢ壮NA“ś±ķ°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄ×ć£Ø £©
A.pH=2µÄĮņĖįČÜŅŗŗ¬ÓŠH+ŹżÄæĪŖ0.01NA
B.øĆ·“Ó¦ŹĶ·ÅSO2·Ö×ÓŹżÄæĪŖ ![]() NA
NA
C.·“Ó¦ÖŠĆæĦ¶ūNa2S2O3×ŖŅʵĵē×ÓŹżÄæĪŖ4NA
D.Čō98gH2SO4ČÜÓŚĖ®ĶźČ«µēĄė£¬Ęä¶ĻĮŃµÄ¹²¼Ū¼üŹżÄæĪŖ2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌCa£ØOH£©2£ØKsp=5.5”Į10©6£©”¢Mg£ØOH£©2£ØKsp=1.2”Į10©11£©”¢AgCl£ØKsp=1.56”Į10©10£©ČżÖÖĪļÖŹ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.Mg£ØOH£©2µÄČܽā¶Č×īŠ”
B.Ca£ØOH£©2µÄČܽā¶Č×īŠ”
C.AgClµÄČܽā¶Č×īŠ”
D.Ķ¬Ņ»ĪĀ¶ČĻĀKspŌ½“óµÄČܽā¶ČŅ²Ō½“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼±ķŹ¾µŖ¼°Ęä»ÆŗĻĪļŌŚŅ»¶ØĢõ¼žĻĀµÄ×Ŗ»Æ¹ŲĻµ:
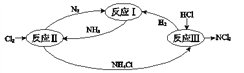
£Ø1£©·“Ó¦I£ŗN2(g)+3H2(g)![]() 2NH3(g) ¦¤H=ØC92 kJmol£1
2NH3(g) ¦¤H=ØC92 kJmol£1
ĻĀ×óĶ¼ŹĒ·“Ó¦IÖŠĘ½ŗā»ģŗĻĘųÖŠNH3µÄĢå»ż·ÖŹżĖęĪĀ¶Č»ņŃ¹Ēæ±ä»ÆµÄĒśĻߣ¬Ķ¼ÖŠL£ØL1”¢L2£©”¢X·Ö±š“ś±ķĪĀ¶Č»ņŃ¹Ē攣ĘäÖŠX“ś±ķµÄŹĒ________£ØĢī”°ĪĀ¶Č”±»ņ”°Ń¹Ēæ”±£©”£
£Ø2£©¢Ł·“Ó¦IIµÄ»Æѧ·½³ĢŹ½ŹĒ_________________________”£
¢Ś·“Ó¦IIĘäÖŠŅ»²½·“Ó¦ĪŖ2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ¦¤H=ØC462 kJmol£1
ŅŃÖŖ£ŗN2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
¶ĻæŖ1 mol HØCN¼üÓė¶ĻæŖ1 mol HØCCl¼üĖłŠčÄÜĮæĻą²īŌ¼ĪŖ________kJ”£
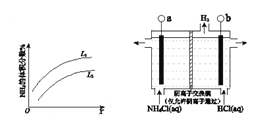
£Ø3£©·“Ó¦IIIŹĒĄūÓĆÉĻĶ¼ĖłŹ¾×°ÖƵē½āÖʱøNCl3£ØĀȵĻÆŗĻ¼ŪĪŖ+1£©£¬ĘäŌĄķŹĒ£ŗNH4Cl+2HCl![]() NCl3 +3H2”ü”£
NCl3 +3H2ӟӣ
¢Łb½ÓµēŌ“µÄ_______¼«£ØĢī”°Õż”±»ņ”°øŗ”±£©”£¢Ś Ńō¼«·“Ó¦Ź½ŹĒ___________________”£
£Ø4£©·“Ó¦IIIµĆµ½µÄNCl3æÉŅŌŗĶNaClO2Öʱø ClO2£¬Ķ¬Ź±Éś³ÉNH3£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ŌŚ±ź×¼×“æöĻĀ£¬11.2 L NO Óė11.2 LO2»ģŗĻŗóĖłŗ¬Ō×ÓŹżĪŖNA
B. 110 g Na2S2ÖŠŗ¬ÓŠµÄĄė×ÓŹżĪŖ3NA
C. 0.1mol”¤L-1Na2CO3ČÜŅŗ1LĖłŗ¬ŅõĄė×ÓŹżÄæŠ”ÓŚ0.1NA
D. 1mol Cl2ČÜÓŚ×ćĮæµÄĖ®ÖŠ£¬·“Ó¦Ź±¶ĻĮѵÄCl-Cl ¼üŹżÄæĪŖNA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻą¶Ō·Ö×ÓÖŹĮæĪŖ70µÄĻ©ĢžµÄ·Ö×ÓŹ½ĪŖ£»ČōøĆĻ©ĢžÓė×ćĮæµÄH2¼Ó³ÉŗóÄÜÉś³Éŗ¬3øö¼×»łµÄĶéĢž£¬ŌņøĆĻ©ĢžµÄæÉÄܵĽį¹¹¼ņŹ½ĪŖ £®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com