
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
分析 A.Na2O2晶体中阴离子和阳离子分别为O22-和Na+;
B.NaOH4晶体中阳离子和阴离子分别为Na+和OH-;
C.${\;}_{12}^{24}$Mg2+离子中的质子和中子分别为12;
D.氯化钠中的质子总数和电子总数都为17+11=28.
解答 解:A.Na2O2晶体中阴离子和阳离子分别为O22-和Na+,二者比值为1:2,故A选;
B.NaOH4晶体中阳离子和阴离子分别为Na+和OH-,二者比值为1:1,故A不选;
C.${\;}_{12}^{24}$Mg2+离子中的质子和中子分别为12,比值为1:1,故C不选;
D.氯化钠中的质子总数和电子总数都为17+11=28,比值为1:1,故D不选.
故选A.
点评 本题考查不同晶体的结构以及原子的构成等知识,侧重于学生的分析能力和基本概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累


科目:高中化学 来源: 题型:选择题
| A. | Na、Cs 是同一主族的元素,所以 NaCl、CsCl晶体的空间结构相似 | |
| B. | HF、HCl、HBr、HI的相对分子质量依次增大,则沸点依次升高 | |
| C. | C、Si均为第ⅣA族元素,则CO2与SiO2的物理性质相似 | |
| D. | NH3分子的价层电子对对数为4,但空间构型为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
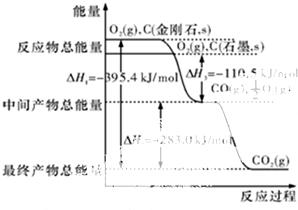 能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.
能源危机当前是一个全球性问题,开源节流是应对能源危机的重要举措.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒后,瓶中立刻泛起大量泡沫 | |
| B. | 实验室中常用排饱和食盐水的方法收集Cl2 | |
| C. | 合成氨工业中不断分离出液氨有利于NH3的生成 | |
| D. | 氯化亚铁溶液久置呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来做燃料 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙醛滴入银氨溶液中,加热煮沸制银镜 | |
| B. | 苯与浓溴水反应制取溴苯 | |
| C. | 向苯酚中加浓溴水观察沉淀 | |
| D. | 1 mol/L CuSO4溶液 2 mL和0.5 mol/L NaOH溶液4 mL 混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
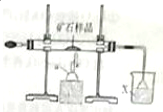 下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:
下面是模拟工业上隔绝空气条件下灼烧铜矿样品(主要成分为Cu2S和Cu2O的混合物)冶炼铜的实验装置图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、Na+、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Ca2+、H+、S2-、ClO- | D. | H+、Cl-、Fe2+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com