
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有2.32 g白色沉淀,在所得的浊液中逐滴加入1 mol·L1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
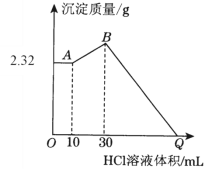
(1)B点的沉淀物的化学式为__________;写出A→B段发生反应的化学方程式_____________________________。
(2)原混合物中MgCl2的质量是________g,AlCl3的质量是________g。
(3)Q点HCl溶液加入量是________mL。
【答案】Mg(OH)2和Al(OH)3 NaAlO2+HCl+H2O=Al(OH)3↓+NaCl 3.80 2.67 170
【解析】
将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水,出现白色固体,向溶液中加入盐酸,0-A段没有沉淀生成说明溶液中含有氢氧根,此时白色固体为氢氧化镁沉淀,溶液中铝全部以偏铝酸根形式存在;A-B段沉淀量增加,此时溶液中的偏铝酸根和盐酸反应生成氢氧化铝沉淀,B点时沉淀质量最大,偏铝酸根全部转化为氢氧化铝沉淀,B点以后沉淀不断溶解,到C点时沉淀全部溶解,据此分析。
(1)向所得悬浊液中加入盐酸时,0-A时固体质量不变,表示没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,A点的沉淀为Mg(OH)2,然后盐酸与偏铝酸钠反应生成氢氧化铝沉淀,到B点时偏铝酸钠完全反应,则B点的沉淀物为Mg(OH)2和Al(OH)3,A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,化学反应方程式为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,故答案为:Mg(OH)2和Al(OH)3;NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
(2)A点沉淀的是氢氧化镁,则n[Mg(OH)2]=![]() =0.04mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.04mol,氯化镁的质量=0.04mol×95g/mol=3.80g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+
=0.04mol,根据Mg原子守恒得n(MgCl2)=n[Mg(OH)2]=0.04mol,氯化镁的质量=0.04mol×95g/mol=3.80g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+![]() +H+=Al(OH)3↓,根据HCl的体积知,n(
+H+=Al(OH)3↓,根据HCl的体积知,n(![]() )=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g;
)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g;
(3)根据铝原子守恒得n(AlCl3)=n(![]() )=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.04mol×2+0.02mol×3+0.03L×1mol/L=0.17mol,Q点溶液为MgCl2、AlCl3和NaCl混合液,Q点相当于所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.17mol;Q点所表示盐酸的体积为:V=
)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.04mol×2+0.02mol×3+0.03L×1mol/L=0.17mol,Q点溶液为MgCl2、AlCl3和NaCl混合液,Q点相当于所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.17mol;Q点所表示盐酸的体积为:V=![]() =0.17L=170mL,故答案为170。
=0.17L=170mL,故答案为170。


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】A为只含有C、H、O三种元素的芳香烃衍生物,且苯环上只有两个取代基。各物质间的相互转化关系如下图所示。

已知:D通过加聚反应得到 E,E分子式为(C9H8O2)n;H分子式为C18H16O6;I中除含有一个苯环外还含有一个六元环。
(1)写出A的分子式:A______________。
(2)写出I、E的结构简式:I______________ E_________________;
(3)A+G→H的反应类型为____________________________;
(4)写出A→F的化学方程式__________________________。
(5)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有_______种,其中一种在NaOH溶液中加热消耗的NaOH最多。写出该同分异构体与NaOH溶液加热反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
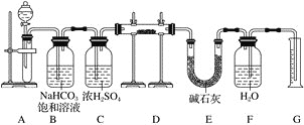
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种化合物的溶解度随温度变化曲线如图所示,下列说法正确的是( )
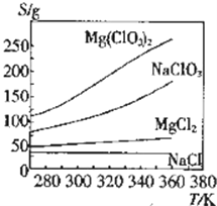
A.NaClO3的溶解是放热过程
B.由图中数据可求出300K时MgCl2饱和溶液的物质的量浓度
C.可采用复分解反应制备Mg(ClO3)2:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
D.若NaCl中含有少量Mg(ClO3)2,可用降温结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态Cu原子电子排布式为:__________。
(2)过渡金属单质及化合物是有机合成反应的重要催化剂。
例如: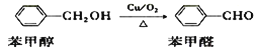
①苯甲醇中碳原子的杂化类型是___________。
②苯甲醇的沸点比苯甲醛_______ 。(填“高”或“低”)
③苯甲醛分子中三种非金属元素C、O、H的电负性由大到小的顺序是____________ 。
(3)多数过渡金属的配离子在水中有颜色,其显色与配合物分裂能有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能,用![]() 表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,
表示,中心离子电荷数越大,中心与配体距离越近,则作用越强,![]() 越大。分裂能(
越大。分裂能(![]() )Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
)Co(H2O)62+_______Co(H2O)63+(填“ > ”“〈”或“ =”)。
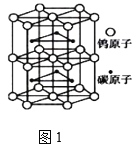
(4)钨与碳组成一种特殊材料,其晶体的晶胞如图1所示,它的熔点为2870℃、硬度类似金刚石,预测它的晶体类型是_________。
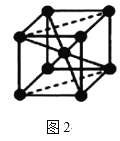
(5)Fe的一种晶体如图2所示,设阿伏加德罗常数的值为NA,铁原子的半径是r cm,该晶体的密度是ρ g/cm3,则铁的相对原子质量为___(只列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式,正确的是( )
A. 稀硝酸和过量的铁屑反应:Fe+4H++ NO3-= Fe3++NO↑+2H2O
B. NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH- = CO32-+H2O
C. 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+= Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1molL-1 NaOH溶液中逐滴加入0.2molL-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )

A. B点,a=12.5
B. D点,c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 在C点升温,CH3COOH电离程度增大,CH3COO-的水解程度减小
D. 在A、B间存在一点,此点水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是

A. m点处反应:H++OH-=H2O
B. p点:c(NH4+)>c(OH-)>c(H+)
C. 若取原溶液做焰色反应实验,焰色应为黄色
D. 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com