
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
分析 A.同种元素组成的性质不同的单质之间互为同位素;
B.N4和N2的状态不明确;
C.N4和N2均由N原子构成;
D.摩尔质量的单位是g/mol.
解答 解:A.N4和N2是N元素组成的性质不同的两种单质,互为同素异形体,故A正确;
B.N4和N2的摩尔质量之比为2:1,故等质量的N4和N2的物质的量之比为1:2,但由于N4和N2所处的状态不一定相同,故N4的体积不一定是N2体积的一半,故B错误;
C.N4和N2均由N原子构成,故相同质量的N4和N2所含N原子个数相同,故C错误;
D.N4的摩尔质量是56g/mol,故D错误;
故选A.
点评 本题考查同素异形体的化学性质、同位素的概念、物质的量的相关计算、摩尔质量的概念,难度不大.要注意平时的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
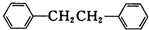 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为: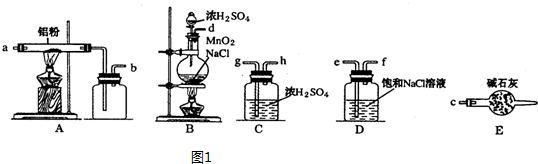
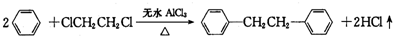
| 名称 | 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
| 1,2一二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
| 无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
| 联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
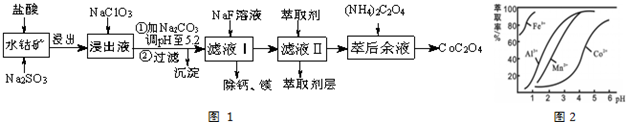
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
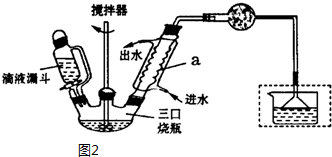
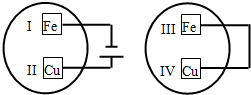 把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )
把铁片和铜片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示),经一段时间后,观察到溶液变红的区域是( )| A. | II和III附近 | B. | II和IV附近 | C. | I和III附近 | D. | I和IV附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 硫在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
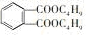 ),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )
),过量摄入塑化剂会对肝肾功能造成影响,甚至诱发癌症.下列有关说法正确的是( )| A. | DBP的分子式为C16H22O4 | |
| B. | 1mol DBP可以与5molH2反应 | |
| C. | 1mol DBP在碱性条件下水解时消耗4molNaOH | |
| D. | DBP所有原子在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B | B. | AB2 | C. | B2A3 | D. | B3A2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com